17.硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用.
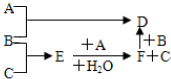
(1)已知:重晶石(BaS0
4)高温煅烧可发生一系列反应,其中部分反应如下:
BaS0
4(s)+4C(s)═BaS(s)+4C0(g)△H=+571.2kJ•mol
-1BaS(s)═Ba(s)+S(s)△H=+460kJ•mol
-1已知:2C(s)+0
2(g)═2CO(g)△H=-221kJ•mol
-1 则:Ba(s)+S(s)+20
2(g)═BaS0
4(s)△H=-1473.2KJ•mol
-1.
(2)雌黄(As
2S
3)是提取砷的主要矿物原料.已知As
2S
3和HN0
3有如下反应:
As
2S
3+10H
++10NO
3-═2H
3AsO
4+3S+10NO
2↑+2H
2O
当反应中转移电子的数目为2mol时,生成H
3As0
4的物质的量为0.4mol.
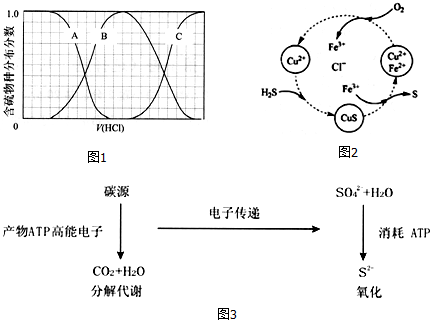
(3)向等物质的量浓度Na
2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H
2S、HS
-、S
2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H
2S气体的逸出).
含硫物种B表示HS
-.在滴加盐酸过程中,溶液中c(Na
+)与含硫各物种浓度的大小关系为c(填字母).
a.c(Na
+)=c(H
2S)+c(HS
-)+2c(S
2-)
b.2c(Na
+)=c(H
2S)+c(HS
-)+c(S
2-)
c.c(Na
+)=3[c(H
2S)+c(HS
-)+c(S
2-)]
(4)将H
2S和空气的混合气体通入FeCl
3、FeCl
2、CuCl
2的混合溶液中反应回收S,其物质转化如图2所示.
①在图示的转化中,化合价变化的元素是O、Fe、S.
②反应中若消耗1molO
2时,保持溶液中Fe
3+的物质的量不变,则转化成S的H
2S的物质的量为2mol.
(5)在油田大量产出的污水中,硫化物主要是以水中的S0
42-被硫酸盐还原菌(SRB)还原产生的S
2-形式存在,其反应机理如图3,请写出以甲烷为碳源时,S0
42-在SRB作用下还原为S
2-的离子反应方程式CH
4+SO
42-$\frac{\underline{\;SRB\;}}{\;}$S
2-+CO
2+2H
2O.