
| X | Y | Z | 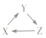 | |
| A | Si | SiO2 | Na2SiO3 | |
| B | HNO3 | NO | NO2 | |
| C | Fe | FeCl3 | Fe(OH)3 | |
| D | Na2O | NaOH | NaCl |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硅和氧气反应生成二氧化硅,二氧化硅和NaOH反应能一步转化为硅酸钠,但硅酸钠不能转化为硅;
B.稀硝酸与铜反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸;
C.铁和氯气反应生成氯化铁,氯化铁和氢氧化钠反应生成氢氧化铁,但氢氧化铁不能一步转化为铁;
D.氧化钠和水反应生成氢氧化钠,氢氧化钠和盐酸反应生成氯化钠,但氯化钠无法一步转化为氧化钠.
解答 解:A.Na2SiO3→Si一步不能转化,故A错误;
B.Cu与稀硝酸反应生成硝酸铜、NO和水,反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,一氧化氮与氧气反应:2NO+O2=2NO2,二氧化氮与水反应3NO2+H2O═2HNO3+NO,符合上述转化关系,故B正确;
C.Fe(OH)3→Fe,不能一步转化,故C错误;
D.NaCl→Na2O,不能一步转化,故D错误;
故选B.
点评 本题考查了物质之间的转化,侧重于元素化合物的综合理解与运用的考查,明确物质的性质及发生的反应是解题关键,采用代入法来分析解答,题目难度中等.


科目:高中化学 来源: 题型:实验题
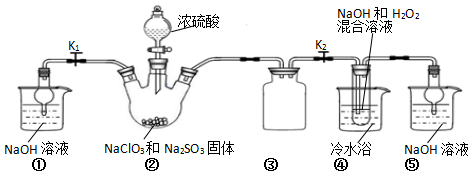 某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
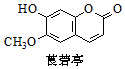
| A. | 分子中只含有一个手性碳原子 | |
| B. | 分子中所有碳原子可能处于同一平面 | |
| C. | 该物质能发生加成、取代和消去反应 | |
| D. | 1 mol该物质最多能与2mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | 4mol/LNaAlO2溶液与7mol/L盐酸等体积混合:4AlO2-+7H++H2O=3Al(OH)3↓+A13+ | |
| C. | K37ClO3与浓盐酸在加热条件下生成氯气:37ClO3-+6Cl-+6H+=37Cl-+3Cl2↑+3H2O | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++NH3↑+Ag+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 碱 | 盐 | 混合物 | |
| A | H2SO3 | 纯碱 | 明矾 | 盐酸 |
| B | HClO4 | 熟石灰 | 石灰石 | 液氯 |
| C | HI | 烧碱 | 小苏打 | 氯水 |
| D | NaHSO4 | 一水合氨 | 食盐 | 漂白粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下水电离的c(H+)为1×10-12mol/L的溶液中:Fe2+、Na+、SO42-、NO3- | |
| B. | 滴加石蕊后呈蓝色的溶液中:K+、AlO2-、Cl-、HCO3- | |
| C. | 含有大量HCO3-的澄清透明溶液中:K+、Al3+、SO42-、Na+ | |
| D. | 常温下c(OH-)/c(H+)=1014的溶液中:K+、Ba2+、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水 | B. | 钠和水的反应2Na+2H2O═2NaOH+H2↑ | ||
| C. | 氟气和水反应2F2+2H2O═4HF+O2 | D. | 氯气和水反应Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com