
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
下列有关焰色反应实验操作注意事项的说法中正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④实验时最好选择本身颜色较浅的火焰
⑤没有铂丝时,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全对
查看答案和解析>>
科目:高中化学 来源: 题型:
用下面的方案进行某些离子的检验,其中方案设计最严密的是( )
A.检验试液中的SO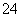 :试液
:试液 无沉淀
无沉淀 白色沉淀
白色沉淀
B.检验试液中的SO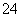 :试液
:试液 无沉淀
无沉淀 白色沉淀
白色沉淀
C.检验试液中的I-:试液 深黄色溶液
深黄色溶液 深黄色溶液
深黄色溶液
D.检验试液中的CO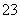 :试液
:试液 白色沉淀
白色沉淀 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和叙述Ⅱ均正确且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4===CuS↓+H2SO4可以发生 |
| C | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O2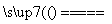 8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:________________________________________。
②实验过程中,需要通入氧气。试写出一个用如下图所示装置制取氧气的化学方程式:________________________________________________________________________。

③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是________________________________________________________________________。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。

①能说明二氧化硫具有氧化性的实验现象为_________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由下列5种基团中的2个不同基团两两组合,形成的有机物能与NaHCO3溶液反应的有( )
①—OH ②—CH3 ③—COOH ④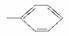 ⑤—CHO
⑤—CHO
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的打“√”,错误的打“×”
(1)在晶体中只要有阴离子就一定有阳离子( )
(2)在晶体中只要有阳离子就一定有阴离子( )
(3)原子晶体的熔点一定比金属晶体的高( )
(4)分子晶体的熔点一定比金属晶体的低( )
(5)离子晶体一定都含有金属元素( )
(6)金属元素和非金属元素组成的晶体不一定是离子晶体( )
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。三种晶体的熔点由高到低的顺序是____________(填化学式)。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为________(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是________,由非极性键形成的非极性分子是________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________________________,属于离子晶体的是____________________,属于原子晶体的是____________________,五种物质的熔点由高到低的顺序是________________。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.________________;B.________________;
C.________________;D.________________。
(5)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1 266 | 1 534 | 183 |
试解释上表中氟化物熔点差异的原因:_____________________________________。
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是________晶体,Ni(CO)4易溶于下列________(填序号)
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com