
氧化镁在医药、建筑等行业应用广泛。硫酸 镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
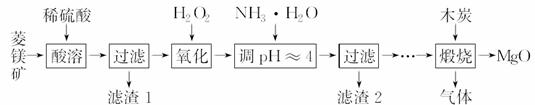
(1)MgCO3与稀硫酸反应的离子方程式为__________________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为____________________________。
(3)滤渣2的成分是________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体可以是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液
c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:__________________________________________________。
解析 (1)MgCO3为难溶性物质,写离子方程式不能拆开。
(2)根据菱镁矿的成分,可知滤液中含有Fe2+,H2O2的作用是将Fe 2+氧化成Fe3+。结合前面使用稀硫酸可知溶液显酸性,所以离子方程式为2FeSO4+H2SO4+H2O2===Fe2(SO4)3+2H2O。
2+氧化成Fe3+。结合前面使用稀硫酸可知溶液显酸性,所以离子方程式为2FeSO4+H2SO4+H2O2===Fe2(SO4)3+2H2O。
(3)根据题意要提取镁元素,必须除去不溶性杂质和铁元素。根据流程,可知滤渣1是不溶性杂质,滤渣2中含的是铁元素。结合加入一水合氨和H2O2,可知滤渣2是Fe(OH)3。
(4)根据反应原理,可知气体中含有SO2、CO2、CO和硫蒸气。①D采用排水集气法,气体必然难溶于水,所以是CO。②SO2和CO2均属于酸性氧化物,均能与NaOH、Na2CO3溶液反应,达不到分步吸收的目的,a、b错误。SO2与稀硝酸反应同时得到NO,产生新杂质,干扰后续操作,c错误。SO2能被KMnO4氧化,而且没有新气体生成,d正确。③根据“淡黄色固体”,可知A中是硫单质。产物中有+4价硫,说明是Na2SO3,进而可知发生氧化还原反应,必然有部分硫化合价降低转化成Na2S。根据化合价升降相等,所以有3S+
6OH- SO
SO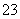 +2S2-+3H2O。
+2S2-+3H2O。
答案 (1)MgCO3+2H+===Mg2++CO2↑+H2O (2)2FeSO4+H2O2+H2SO4===Fe2(SO4)3+2H2O (3)Fe(OH)3 (4)①CO ②d ③3S+6OH- 2S2-+SO
2S2-+SO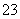 +3H2O
+3H2O


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
下列实验方法:①用渗析法分离蛋白质和葡萄糖的混合液;②用盐析法分离油脂皂化反应的产物;③用升华法分离碘单质和沙子的混合物;④用重结晶法分离硝酸钾和氯化钠的混合物;⑤用分液法分离水和溴乙烷的混合物;⑥用蒸馏法分离酒精与苯酚(沸点为182 ℃)的混合物
你认为这些方法( )
A.只有①不正确 B.②⑤⑥不正确
C.只有③④⑥正确 D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为某有机物分别与各种试剂反应的现象,则这种有机物可能是( )
| 试剂 | 钠 | 酸性高锰酸钾溶液 | NaHCO3溶液 |
| 现象 | 放出气体 | 褪色 | 不反应 |
A.CH2===CH—COOH B.CH2===CHCH3
C.CH3COOCH2CH3 D.CH2===CHCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组通过实验探究Cu及其化合物的性质,下列操作正确且能达到目的的是
A.将铜丝插入浓硫酸中加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色
B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体
D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案能达到预期目的的是
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的铁粉 ②氢氧化钠溶液保存在配有橡胶塞的细口瓶中 ③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO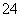 ④用丁达尔效应可以区分食盐水和淀粉溶液 ⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂
④用丁达尔效应可以区分食盐水和淀粉溶液 ⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂
A.①②④ B.①②⑤
C.②④⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
要使工业废水中的Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
| 化合物 | PbSO4 | PbCO3 | PbS |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,沉淀剂最好选用( )
A.硫化物 B.硫酸盐
C.碳酸盐 D.以上沉淀剂均可
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com