
【题目】标准状况下将VLHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A. ρ=(36.5V+22400)/(22.4+22.4V) B. ω=36.5c/(1000ρ)
C. ω=36.5V/(36.5V+22400) D. c=1000Vρ/(36.5V+22400)
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO![]() 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(假设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________________。
(4)判断BaCl2已过量的方法是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.酸性:H2SO4 > HClO4B.半径:r(Na+) > r(S2-)
C.稳定性:PH3 < H2OD.碱性:Ba(OH)2 < Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子晶体中一定存在共价键和范德华力
B.由非金属元素组成的化合物一定是共价化合物
C.原子晶体和分子晶体一定均含有共价键,离子晶体也可能含有共价键
D.两个非金属元素原子间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出“可充室温Na-CO2电池”(Rechargeable Room-Temperature Na-CO2 Batter-ies)现已取得突破性进展,其有望取代即将“枯竭”的锂电池,该电池结构如图所示。下列说法错误的是
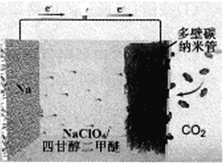
A. 电池工作时,正极发生反应:4Na++3CO2+4e-==2Na2CO3+C
B. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.46 g
C. 多壁碳纳米管的作用主要是导电及吸附CO2
D. 电池中四甘醇二甲醚可用饱和食盐水代替实现Na+传导
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。回答下列问题:
Ⅰ.实验室制备NaN3
水合肼(N2H4·H2O) 与亚硝酸甲酯(CH3ONO)在氢氧化钠存在下制备NaN3,其反应装置如图所示:
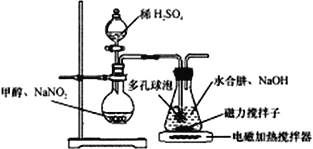
已知:2CH3OH+2NaNO2+H2SO4→2CH3ONO+ Na2SO4+2H2O; NaN3无色无味,微溶于醇、溶于水
(1)N2H4的电子式为_______________;NaN3晶体中阴离子与阳离子个数比为______________。
(2)装置中多孔球泡的作用是___________________。
(3)锥形瓶中水合肼与亚硝酸甲酯在30℃时可以反应生成叠氮酸钠、甲醇等物质,写出该反应的化学方程式_______________________________。
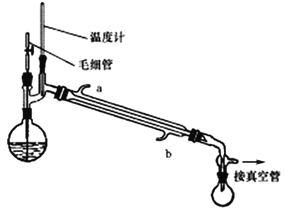
Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照下图所示装置进行减压蒸馏。
已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |
NaN3在40℃时分解
(4)实验时冷凝管中冷却水要“b进a出”原因是______________________。
(5)甲醇回收时需用减压蒸馏的原因是________________________。
(6)下列有关毛细管的作用说法正确的是_______________。
A.平衡圆底烧瓶内外压 B.作为气化中心,使蒸馏平稳
C.避免液体过热而暴沸 D.冷凝回流作用
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得NaN3湿品;再用去离子水重结晶得NaN3产品并用碘量法测定产品纯度。取产品6.50g加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入20.00mL 1.00mol·L-lKMnO4溶液,溶液呈紫红色;再加入足量KI溶液消耗过量的KMnO4溶液;其后用0.100mol·L-lNa2S2O3标准溶液滴定所产生的I2,消耗Na2S2O3溶液30.00mL。
(7)实验所得产品的纯度为______________________。
已知:①产品中杂质不参与反应;
②测定过程中发生的反应:
10NaN3+2KMnO4+8H2SO4==2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑;
10KI+2KMnO4+8H2SO4==2MnSO4+6K2SO4+8H2O+5I2;
I2+2Na2S2O3==2NaI +Na2S4O6。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.全部由非金属元素形成的化合物一定是共价化合物
B.离子化合物中可能含有非极性键
C.共价化合物中肯定不含有离子键
D.化学变化过程,一定会破坏旧的化学键,同时形成新的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中不正确的是()
A. 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2NA
B. 压强为1.01×105Pa时,48g O2和O3的混合物中含有的原子数为3NA
C. 常温下,8 g NH4NO3所含的氮原子数为0.1NA
D. 1.7 g H2O2中含有的电子数为0.9NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com