
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
分析 干燥的氯气不具有漂白作用,氯气与水反应生成HClO,HClO具有漂白性,能使干燥的蓝色石蕊试纸先变红后褪色物质应既具有酸性,又有HClO存在,据此解答.
解答 ①氯气不具有漂白性,不能使干燥的石蕊试纸褪色,故①错误;
②液氯是氯气的液态形式是纯净物,不具有漂白性,不能使干燥的石蕊试纸褪色,故②错误;
③新制氯水中含有HCl和HClO,能使干燥的蓝色石蕊试纸先变红后褪色,故③正确;
④敞口放置的久置氯水,氯水中次氯酸见光分解生成氯化氢和氧气,溶液为盐酸溶液,所以只变红不褪色,故④错误;
⑤盐酸具有酸性,能够使石蕊变红,不具有漂白性,所以不能使石蕊褪色,故⑤错误;
⑥用盐酸酸化的漂白粉溶液,用盐酸酸化的漂白粉溶液中含有HCl和HClO,能使干燥的蓝色石蕊试纸先变红后褪色,故⑤正确;
故选:C.
点评 本题考查了氯气、次氯酸的性质,明确氯气不具有漂白性,具有漂白性的物质是次氯酸是解题关键,注意次氯酸的不稳定性,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的装置常用于制取气体并检验气体的性质.下列有关说法正确的是( )
如图所示的装置常用于制取气体并检验气体的性质.下列有关说法正确的是( )| A. | 关闭分液漏斗的活塞.将干燥管末端放人水中,微热烧瓶,有气泡从水中冒出,停止加热后,燥管内有水柱形成,表明装置不漏气 | |
| B. | 若装置用于制取氯气并验证其具有漂白性,则A中所用试剂为稀盐酸,B中所用药品为KMnO4固体,C中为品红溶液 | |
| C. | 若装置用于制取SO2并验证其具有漂白性,则A中所用试剂为浓硫酸,B中所用药品为Na2SO3固体,C中为酸性KMnO4溶液 | |
| D. | 若实验时B中盛放固体NaOH,A中为浓氨水,C中为稀AgNO3溶液,则实验过程中,C试管中看不到明显的实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
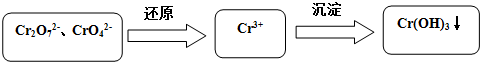
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | c(HCO${\;}_{3}^{-}$)>c(ClO-)>c(OH-) | |
| C. | c(HClO)+c(ClO-)=c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(ClO-)+c(OH-)+c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、Na2SO4、NaCl | B. | NaCl、Na2SO4、NaOH | ||
| C. | NaOH、NaCl、Na2SO4 | D. | Na2SO4、NaOH、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
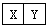 ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存,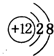 .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族.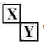 ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com