
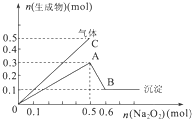
 向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为( )
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为( )| A、2:5:4 |
| B、1:2:2 |
| C、2:2:1 |
| D、9:2:4 |


科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、c(Na+)=c(CH3COO-)+c(OH-) |
| C、c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
| D、c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液 |
| B、从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl |
| C、用pH试纸测定某Na2CO3溶液的pH 值 |
| D、配制75%酒精溶液100g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、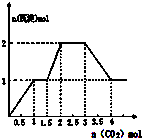 |
B、 |
C、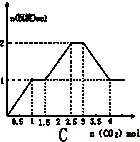 |
D、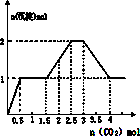 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g);△H=+853.7kJ?mol-1 | ||||
B、FeS2(s)+
| ||||
| C、4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g);△H=+3414.8kJ?mol-1 | ||||
D、FeS2(s)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn2+>Cu2+>Ag+ |
| B、Zn2+>Ag+>Cu2+ |
| C、Cu2+>Ag+>Zn2+ |
| D、Ag+>Cu2+>Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com