
(05年上海卷)酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO3 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3?10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
① 计算吸收液中NaNO2和NaNO3物质的量之比。
② 1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
(1)48
(2)m(Na2CO3?10H2O) = 572g
(3)①2NO2+Na2CO3→NaNO2+NaNO3+CO2↑△m=48g
NO+NO2+Na2CO3→2NaNO2+CO2↑△m=32g
设由NO2与纯碱反应产生的CO2为amol 由NO和NO2与纯碱反应产生的CO2为bmol![]()
n(NaNO2)n(NaNO3) = 53
②设生成的n(NaNO2)为5x mol,n(NaNO3)为3x mol
据Na+守恒:5x+3x=8x=0.5
m(NaNO2)=172.5g,m(H2O)余=1000×78.8%-688=100g
析出:m(NaNO2)(最大)=172.5-71.2=101.3g


科目:高中化学 来源: 题型:
(05年上海卷)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
|
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b)烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a)控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c)确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4
(c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
(05年上海卷)某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。

加热聚丙烯废塑料得到的产物如右表:

(1) 试管A中残余物有多种用途,如下列转化就可可制取高聚物聚乙炔。

写出反应②~③的化学方程式 、
。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有 种。
(3)锥形瓶C中观察到的现象 。
经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为 。
(4)写出C中逸出的气体在工业上的两种用途 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(05年上海卷)某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。

加热聚丙烯废塑料得到的产物如右表:
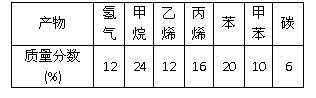
(1) 试管A中残余物有多种用途,如下列转化就可可制取高聚物聚乙炔。

写出反应②~③的化学方程式 、
。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有 种。
(3)锥形瓶C中观察到的现象 。
经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为 。
(4)写出C中逸出的气体在工业上的两种用途 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(05年上海卷)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO3 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3?10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
① 计算吸收液中NaNO2和NaNO3物质的量之比。
② 1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com