
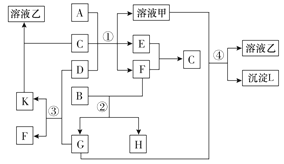
【题目】在如图中表示的是有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略)。
(1)A、C代表的物质分别为______、______(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是 _____________;
(3)反应②中,若B与F物质的量之比为4:3,G、H物质的量之比为______;
(4)反应④的离子方程式为______________。
【答案】Al H2O 2H2O+2Na2O2=4NaOH+O2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 1:1 CO2+2OH-=CO32-+H2O 、2AlO2-+CO2+3H2O=2Al(OH)3↓+ CO32-
【解析】
题干信息:A为常见的金属单质,B为非金属单质(一般是黑色粉末)推断为C (碳)单质,C是常见的无色无味液体可以推断C为H2O,D是淡黄色的固体化合物判断为Na2O2,E、F为O2和H2,二者反应生成水,A是常见金属,与另一种固体在水中反应生成O2和H2,则该金属A为Al单质;固体D为Na2O2,能与水和CO2反应,则G为CO2;说明K为Na2CO3,F为O2,则E为H2;题给信息黑色单质B(C单质)与F(O2)反应得到G(CO2);C和O2反应可生成CO2和CO,则H为CO;A、C、D反应产生E、F、溶液甲,由于A是Al,C是H2O,D是Na2O2,E为H2,F是O2,甲是NaAlO2;G是CO2,其与过氧化钠反应生成碳酸钠和氧气,碳酸钠溶于水中得到的溶液乙为碳酸钠溶液。溶液甲为NaOH和NaAlO2的混合液,将CO2通入甲溶液,反应产生Al(OH)3沉淀和Na2CO3溶液,则沉淀L是Al(OH)3,结合物质的性质解答该题。
根据上述分析可知:A是Al,B是C,C是H2O,D是Na2O2,E是H2,F是O2,G是CO2,H是CO,K是Na2CO3,甲是NaAlO2,乙是NaHCO3,L是Al(OH)3。
(1)依据推断可知,A是Al,C是H2O;
(2)反应①中的C、D均过量,生成的氢氧化钠溶液能和A完全反应,该反应的化学方程式是:2Na2O2+2H2O=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3) B是C,F是O2,若二者按物质的量之比为4:3发生反应,根据反应前后各种元素的原子个数相等,可得反应的方程式为:4C+3O2![]() 2CO+2CO2,则反应产生的CO2、CO的物质的量的比n(CO2):n(CO)=2:2=1:1;
2CO+2CO2,则反应产生的CO2、CO的物质的量的比n(CO2):n(CO)=2:2=1:1;
(4)反应④是向氢氧化钠和偏铝酸钠混合溶液中通入二氧化碳,发生反应生成氢氧化铝沉淀和碳酸钠,反应④的离子方程式为CO2+2OH-=CO32-+H2O 、2AlO2-+CO2+3H2O=2Al(OH)3↓+ CO32-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向300 mL 1 mol·L-1的稀硝酸中,加入5.6 g铁粉,充分反应后,铁粉全部溶解(假设还原产物只有NO),下列说法不正确的是( )
A. 最终所得溶液中既有Fe2+又有Fe3+
B. 最终溶液中,硝酸无剩余
C. 标准状况下生成NO的体积为1.68 L
D. 再向最终所得溶液中滴加稀硝酸,无明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的反应判断下列说法中错误的是
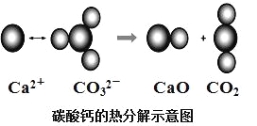
A. CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B. 该反应的焓变大于零
C. 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D. 由该反应可推出凡是需要加热才发生的反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硝酸铵的流程如下图所示:
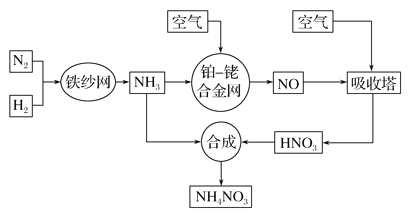
请回答下列问题:
(1)已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1。
2NH3(g) ΔH=-92.4 kJ· mol-1。
①在500 ℃、2.02×107 Pa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量________(填“大于”、“小于”或“等于”)92.4 kJ。
②为提高H2的转化率,实际生产中宜采取的措施有________(填字母)。
A.降低温度
B.最适合催化剂活性的适当高温
C.适当增大压强
D.减小压强
E.循环利用和不断补充氮气
F.及时移出氨
(2)该流程中铂—铑合金网上的氧化还原反应为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。
4NO(g)+6H2O(g)。
①已知铂—铑合金网未预热也会发热,则随着温度升高,该反应的化学平衡常数K________(填“增大”、“减小”或“不变”),理由是__________________________________________________________________。
②若其他条件不变,则下列图像正确的是________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是( )
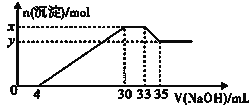
A.x-y=0.01molB.原溶液中c(Cl-)=0.75mol/L
C.原溶液的c(H+)=0.1mol/LD.原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原是一类重要的反应。
(1)某同学写出以下三个化学方程式(未配平)
①N2O4+H2O→HNO3+HNO2 ②NO+HNO3→N2O3+H2O ③NH3+NO→HNO2+H2O
其中你认为一定不可能实现的是(填代号)____________;
(2)以下反应中H2O2仅体现还原性的是(填代号)____________,H2O2既体现氧化性又体现还原性的是(填代号)____________,从反应中判断H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是_______________;
A.H2O2+2Fe2++2H+=2Fe3++2H2O
B.2H2O2=2H2O+O2↑
C.Ag2O+H2O2=2Ag+O2↑+H2O
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4=MnO2+H2SO4
(3)用“双线桥法”标明以下反应中电子转移的方向和数目________,若反应中有3.01×1023个电子转移,则被氧化的还原剂的物质的量为___________。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是_______
A.将胆矾加热除去结晶水后,称取16g溶解在1L水中
B.称取25g胆矾溶于水,然后将此溶液稀释至1L
C.称取25g胆矾溶解在1L水里
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上研究高效处理煤燃烧释放出来的SO2,有利于减小环境污染。在T℃时,利用CO处理SO2的反应为:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H=akJ/mol;
2CO2(g)+S(l) △H=akJ/mol;
(1)已知T℃时:C(s)+![]() O2(g)=CO(g) △H1=-110.5kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol
S(l)+O2(g)=SO2(g) △H2=-290.0kJ/mol
C(s)+O2(g)=CO2(g) △H3=-390.0kJ/mol
则T℃时,a=___。
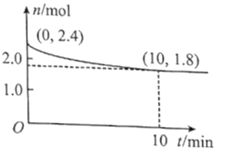
(2)在T℃下,将1.4molCO和1molSO2通入2L恒容容器中发生上述反应,反应体系气体总物质的量随时间变化如图;在0~10min,反应的平均速率v(CO)=___,SO2的平衡转化率![]() (SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
(SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
(3)实验测得:v正=v(CO)消耗=k正c(CO)c(SO2),v逆=v(CO2)消耗=k逆![]() ,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),
,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),![]() 的值将___(填“增大”、“减小”或“不变”)。
的值将___(填“增大”、“减小”或“不变”)。
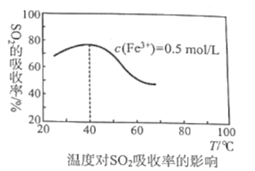
(4)某科研团队研究用Fe2(SO4)3(aq)处理SO2:Fe3+溶液吸收SO2发生的离子反应方程式为___;其他外界条件不变下,在相同时间内温度对SO2吸收率的影响结果如图,在40℃前,SO2的吸收率随温度变化的可能原因是___;在40℃后,SO2的吸收率发生的变化是温度升高该反应逆向移动的结果,导致反应逆向移动的原因:一是该反应为放热反应,二是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
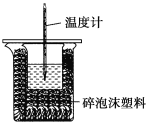
【题目】某实验小组用100mL0.50mol/LNaOH溶液与60mL0.50mol/L硫酸进行中和热的测定。装置如图所示,回答下列问题:
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体____g。
(2)图中装置缺少的仪器是____。
(3)硫酸稍过量的原因是____。
(4)请填写下表中的平均温度差:
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50 mol/L NaOH溶液与0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容为c=4.18J/(g℃)则上述实验中和热ΔH=___(取小数点后一位)
(6)上述实验结果与57.3kJ/mol有偏差产生偏差的原因可能是____
A.量取NaOH溶液时仰视读数
B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差
D.用铜丝代替玻璃棒搅拌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com