
| A. | 盐酸:强电解质 | B. | 氧化铝:两性氧化物 | ||
| C. | 熔融的硫酸钠:电解质 | D. | 次氯酸:氧化性酸 |
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生 | |
| B. | SiO2具有很好的导电性,可用于制取光导纤维 | |
| C. | 节日燃放的烟花,是碱金属、锶、铂、铁等金属化合物焰色反应所呈现的色彩 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
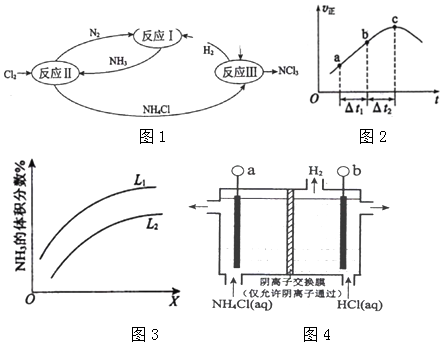
 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
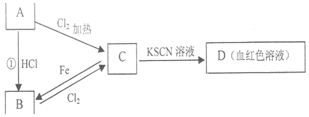
 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同一周期.m、n、s是由这些元素组成的二元化合物,p、q分别是W、Z两元素对应的单质,0.001mol•L-1s溶液的pH为3,t是混合溶液,且该溶液具有漂白性.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同一周期.m、n、s是由这些元素组成的二元化合物,p、q分别是W、Z两元素对应的单质,0.001mol•L-1s溶液的pH为3,t是混合溶液,且该溶液具有漂白性.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 元素Y分别与W、X、Z形成的化合物中一定含有离子键 | |
| B. | 离子半径:X<Y<Z | |
| C. | 由元素W、X组成的化合物中一定只含极性键 | |
| D. | s为强酸,r为弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z | |
| B. | 单质熔点:W>X | |
| C. | X、Y的氧化物均能与Z的氧化物对应的水化物反应 | |
| D. | X、W的最简单氢化物的水溶液均显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
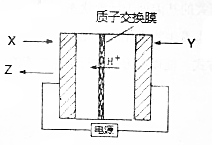 氨是生产氮肥、尿素等物质的重要原料,电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料,电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | 图中所示物质中,X为H2,Y为N2 | |
| B. | Y参与的电极反应为H2+2e-═2H+ | |
| C. | 当有3gH+通过质子交换膜时,Z的体积为22.4L | |
| D. | 反应过程中左边区域溶液PH逐渐升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com