
【题目】连二亚硫酸钠(![]() )俗称保险粉,是一种强还原剂,工业上可通过吸收大气污染物(含有
)俗称保险粉,是一种强还原剂,工业上可通过吸收大气污染物(含有![]() 、NO等)制取,同时还可得到
、NO等)制取,同时还可得到![]() 产品,工艺流程图如下(Ce为铈元素):
产品,工艺流程图如下(Ce为铈元素):
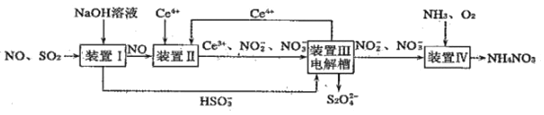
请回答下列问题:
(1)装置Ⅰ中可生成![]() 。常温下
。常温下![]() 溶液呈酸性的原因是_____________。
溶液呈酸性的原因是_____________。
(2)装置Ⅱ中酸性条件下,NO被![]() 氧化为
氧化为![]() 时,氧化产物与还原产物的物质的量之比为_______________。
时,氧化产物与还原产物的物质的量之比为_______________。
(3)装置Ⅲ中阴极上的电极反应式为_______________。若装置Ⅳ中![]() 的浓度为11.5g·
的浓度为11.5g·![]() ,要使1
,要使1![]() 该溶液中的
该溶液中的![]() 完全转化为
完全转化为![]() ,至少向装置Ⅳ中通入标准状况下的
,至少向装置Ⅳ中通入标准状况下的![]() ____________L。
____________L。
(4)![]() 在空气中容易被氧化,其反应方程式可能为:
在空气中容易被氧化,其反应方程式可能为:
①![]() ;
;
②![]() 。
。
请设计实验证明氧化时一定有反应②发生____________。
(5)![]() 一空气质子交换膜燃料电池原理示意图如下:
一空气质子交换膜燃料电池原理示意图如下:
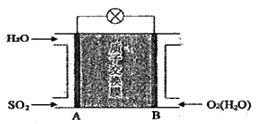
质子的流动方向为____________(“从A到B”或“从B到A”),负极的电极反应式为____________________。
【答案】 HSO3-在溶液中存在电离平衡和水解平衡:HSO3-![]() SO32-+H+,HSO3-+H2O
SO32-+H+,HSO3-+H2O![]() H2SO3+OH-,由于HSO3-的电离程度大于水解程度,故溶液中的c(H+)>c(OH-),溶液呈酸性 1:3 2HSO3-+2e-+2H+=S2O42-+2H2O 2.8 取少量固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②(或取少量固体溶于水中,若闻到刺激性气味,则证明是②) 从A到B SO2-2e- +2H2O=SO42-+4H+
H2SO3+OH-,由于HSO3-的电离程度大于水解程度,故溶液中的c(H+)>c(OH-),溶液呈酸性 1:3 2HSO3-+2e-+2H+=S2O42-+2H2O 2.8 取少量固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②(或取少量固体溶于水中,若闻到刺激性气味,则证明是②) 从A到B SO2-2e- +2H2O=SO42-+4H+
【解析】试题分析:本题以Na2S2O4的制备流程为载体,考查流程的分析、盐溶液酸碱性的判断、氧化还原反应的计算、电极反应式的书写、原电池原理和实验方案的设计。
(1)装置I中发生的反应为SO2+NaOH=NaHSO3。NaHSO3属于弱酸的酸式盐,在NaHSO3溶液中HSO3-既存在电离平衡HSO3-![]() H++SO32-又存在水解平衡HSO3-+H2O
H++SO32-又存在水解平衡HSO3-+H2O![]() H2SO3+OH-,由于HSO3-的电离程度大于水解程度,溶液中c(H+)
H2SO3+OH-,由于HSO3-的电离程度大于水解程度,溶液中c(H+)![]() c(OH-),溶液呈酸性。
c(OH-),溶液呈酸性。
(2)根据流程,NO被Ce4+氧化为NO3-,N元素的化合价由+2价升至+5价,NO3-为氧化产物,Ce4+被还原为Ce3+,Ce3+为还原产物,根据得失电子守恒,3n(NO3-)=n(Ce3+),n(NO3-):n(Ce3+)=1:3,即氧化产物与还原产物物质的量之比为1:3。
(3)在装置III的电解槽中发生电解反应,Ce3+被氧化成Ce4+,HSO3-被还原成S2O42-,S元素的化合价由+4价降至+3价,阴极电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O。装置IV中NO2-被氧化成NO3-,N元素的化合价由+3价升至+5价,根据得失电子守恒,2n(NO2-)=4n(O2),n(O2)=![]() n(NO2-)=
n(NO2-)=![]() =0.125mol,至少向装置IV中通入标准状况下O2的体积为0.125mol
=0.125mol,至少向装置IV中通入标准状况下O2的体积为0.125mol![]() 22.4L/mol=2.8L。
22.4L/mol=2.8L。
(4)根据反应的原理,要证明氧化时反应②一定发生,即检验固体中含NaHSO4。证明氧化时一定有反应②发生的实验方案为:取少量固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明一定有反应②发生(或取少量固体溶于水中,若闻到刺激性气味,则证明一定有反应②发生)。
(5)通入O2的B电极为正极,正极电极反应式为O2+4e-+4H+=2H2O;通入SO2的A电极为负极,原电池中阳离子向正极移动,质子的流动方向从A到B。负极上SO2被氧化成H2SO4,1molSO2失去2mol电子生成1molSO42-,负极电极反应式为SO2-2e-+2H2O=SO42-+4H+。


科目:高中化学 来源: 题型:
【题目】如图所示实验装置(夹持装置已省略)及实验方案对环境友好的是( )
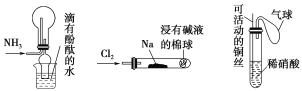
(a) (b) (c)
①实验室收集氨用(a)装置 ②实验室中做氯气与钠反应的实验时用(b)装置 ③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨与酸反应生成铵盐的实验 ④实验室中用(c)装置进行铜与稀硝酸的反应
A. ②③④ B. ①②③
C. ①②④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我国的火力发电机组绝大多数为燃煤机组,而以燃煤为主的电力生产所造成的环境污染是制约电力工业发展的一个重要因素,其中氮氧化物(NOx)是继粉尘和二氧化硫之后燃煤电站环保治理的重点。
(1)燃煤烟气脱硫的方法很多,如石灰石—石膏法、氨水法等。其中石灰石-石膏法脱硫的原理第一步是SO2+Ca(OH)2![]() CaSO3+H2O,然后再将产物氧化制成石膏,写出该反应的化学方程式: 。
CaSO3+H2O,然后再将产物氧化制成石膏,写出该反应的化学方程式: 。
(2)燃煤烟气脱硝可采用氨(NH3)作为还原介质,在催化剂及氧气存在的条件下,氮氧化物(NOx)与还原剂发生反应,生成无害的氮气和水,写出二氧化氮与氨反应的化学方程式: 。
(3)我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示:
浓度限值(mg·m-3) | ||
一级标准 | 二级标准 | 三级标准 |
0.15 | 0.50 | 0.70 |
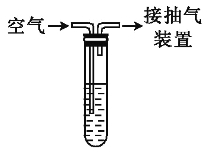
现有某化学兴趣小组按图所示的实验装置对某地空气中二氧化硫含量进行测定:向试管中加入1.00 mL 1.00×10-3 mol·L-1碘水,加入适量水,再加入2~3滴淀粉溶液使溶液显蓝色,通过抽气装置缓慢抽气,使空气由导气管进入试管与碘水充分反应,当溶液由蓝色变为无色时,恰好完全反应(反应的化学方程式:SO2+I2+2H2O![]() H2SO4+2HI),实验过程中进入试管内的空气的总体积为0.1 m3。请计算此空气中二氧化硫的浓度为多少mg·m-3,并判断二氧化硫的浓度级别为几级。
H2SO4+2HI),实验过程中进入试管内的空气的总体积为0.1 m3。请计算此空气中二氧化硫的浓度为多少mg·m-3,并判断二氧化硫的浓度级别为几级。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有钠、钾及钠钾合金,对于它们三者熔点高低比较正确的是( )
A.钠钾合金>钠>钾B.钠>钾>钠钾合金
C.钠>钠钾合金>钾D.钾>钠钾合金>钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下能发生银镜反应,不能发生水解反应的是( )
①甲酸甲酯 ②乙酸乙酯 ③葡萄糖 ④果糖
A. ①④ B. ②③ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示
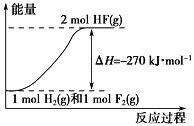
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com