
【题目】下列说法正确的是( )
A. 向CH3CH2Br中滴入AgNO3溶液以检验溴元素
B. 乙醇能使酸性高锰酸钾溶液褪色
C. 向无水乙醇中加入浓H2SO4,加热至170 ℃,产生的使酸性KMnO4溶液褪色的气体只是乙烯
D. ![]() 遇FeCl3溶液可显紫色
遇FeCl3溶液可显紫色
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素.请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为_______;
(2)B元素的负一价离子的电子层结构都与氩相同,B的原子结构示意图为____;
(3)C元素是第三周期中无未成对电子的主族元素,它的轨道排布式为___________;
(4)D元素的正三价离子的3d能级为半充满,其基态原子的电子排布式为______ 。
(5)E原子共有3个价电子,其中一个价电子位于第三能层d轨道,指出该元素在周期
表中所处的周期数和族序数:____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 物质熔、沸点的高低顺序是晶体硅>氯化钠>冰>氖气
B. 微粒半径由大到小的顺序是H+>Li+>H-
C. 金刚石的硬度、熔点、沸点都低于晶体硅
D. CO2、HCl、CF4、PCl3四种物质分子中的所有原子都满足最外层为8电子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X 常温下为气体, a、b、c 是中学化学常见物质, 均由常见元素组成, 转化关系(反应条件略去)如图所示, 下列说法不正确的是
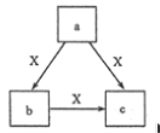
A. 若 X 为 O2, a 为一种固态单质, 则 c 可能为 CO2或 SO3
B. 若 b 为固态非金属单质, b 与 X 所含元素同主族, 则 c 也能与 X 反应
C. 若 a、 b、 c 焰色反应均呈黄色, 水溶液均呈碱性, 则 a 中可能既含有离子键又含有共价键
D. 若 b 为气态非金属单质, b 与 X 所含元素同周期, 则 X 与 b 所含元素原子的核电荷数相差 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些食物的近似pH值如下表:
食物 | 苹果 | 葡萄 | 牛奶 | 玉米粥 |
pH | 2.9-3.3 | 3.5-4.6 | 6.3-6.6 | 6.8-8.0 |
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的是
A. 苹果 B. 葡萄 C. 牛奶 D. 玉米粥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气 CO2 可制取甲醇。 下列两个反应的能量关系如图:
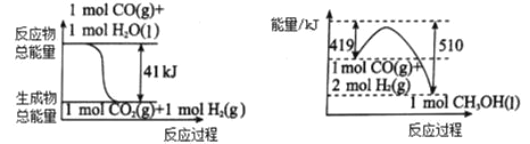
则 CO2与 H2 反应生成 CH3OH 的热化学方程式为_______________________。
(2)CH4 和 H2O(g)通过下列转化也可以制得 CH3OH;
I. CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
II. CO(g)+2H2(g) ![]() CH3OH(g) △H<0
CH3OH(g) △H<0
将 1.0 mol CH4和 3.0 mol H2O(g)通入反应室(容积为 100 L)中,在一定条件下发生反应 I, CH4 的转化率与温度、压强的关系如下图所示:
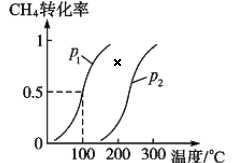
①已知压强 p1, 温度为 100 ℃时反应 I 达到平衡所需的时间为 5 min,则用 H2表示的平均反应速率为______________;
②图中的 p1_______p2(填“<”、 “>”或“=”),判断的理由是________________________。
③若反应 II 在恒容密闭容器进行,下列能判断反应 II 达到平衡状态的是_________(填字母)。
a.CH3OH 的生成速率与消耗 CO 的速率相等
b.混合气体的密度不变
c混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④ 在某温度下,将一定量的CO和 H2投入10 L 的密闭容器中发生反应 II, 5 min 时达到平衡,各物质的物质的浓度(mol·L ﹣1)变化如下表所示:
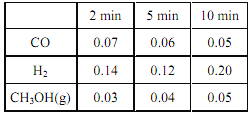
若 5 min 时只改变了某一条件,则所改变的条件是_____________; 10 min 时测得各物质浓度如上表,此时 v正_______v逆(填“<”、 “>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
C. SO2、SO3、BF3、NCl3都是极性分子
D. 向含有0.1 mol [Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液只能生成0.1 mol AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、密闭容器中投入一定量的CaCO3发生分解反应:CaCO3(s)![]() CaO(s)+CO2(g) ΔH>0。达到平衡时,测得体系中气体的压强为P。若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是( )
CaO(s)+CO2(g) ΔH>0。达到平衡时,测得体系中气体的压强为P。若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是( )
A. 当CaCO3的浓度不再变化时,表明达到平衡状态
B. 重新达到新平衡时,CO2的压强为P
C. 扩大容器体积,重新达到平衡时n(CO2)增多
D. 常温常压下CaCO3的分解反应不一定自发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是( )
A.用酒精萃取碘水中的碘
B.少量金属钠保存在煤油中
C.不慎洒出的少量酒精在桌上着火时,立即用湿布盖灭
D.配制1.00mol/L NaCl溶液时,将称好的NaCl固体放入烧杯中溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com