
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
①2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1;
②H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1;
③C(s)+1/2O2(g)===CO(g) ΔH=-110.5 kJ·mol-1;
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1;
⑤CO2(g)+2H2O(g)===2CH4(g)+2O2(g) ΔH=+890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是___________________________________________。
(2)H2的燃烧热为_______________________________________________________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s)+H2O(g)===H2(g)+CO(g) ΔH=a kJ·mol-1;则a=________;该反应的熵ΔS________0(选填“>”、“=”或“<”)。
科目:高中化学 来源: 题型:
有关Na2CO3和NaHCO3的叙述中正确的是
A.Na2CO3和NaHCO3均可与澄清石灰水反应
B.NaHCO3比Na2CO3热稳定性强
C.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
D.Na2CO3俗名小苏打,NaHCO3俗名纯碱,其溶液均显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不能用平衡移动原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.加入催化剂有利于氨的合成
D.工业制取金属钾 Na(l)+KCl(l)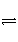
 NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
容积固定为3 L的某密闭容器中加入1 mol A、2 mol B,一定温度下发生如下反应:A(s)+2B(g)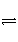
 C(g)+D(g),经反应5 min后,测得C的浓度为0.3 mol·L-1。则下列说法中正确的是( )
C(g)+D(g),经反应5 min后,测得C的浓度为0.3 mol·L-1。则下列说法中正确的是( )
A.5 min内D的平均反应速率为0.02 mol·L-1·min-1
B.5 min内A的平均反应速率为0.06 mol·L-1·min-1
C.经5 min后,向容器内再加入C,正反应速率变小
D.平衡状态时,生成1 mol D时同时生成1 mol A
查看答案和解析>>
科目:高中化学 来源: 题型:
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI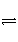
 H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
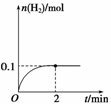
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)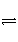
 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l)
ΔH=-572 kJ·mol-1
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于F、Cl、Br、I性质的比较,不正确的是 ( )
A、它们的原子核外电子层数随核电荷数的增加而增多
B、被其他卤素单质从卤化物中置换出来的可能性随核电荷数的增加而增大
C、它们的氢化物的稳定性随核电荷数的增加而增强
D、单质的颜色随核电荷数增加而加深
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行下列反应:X2(g)+Y2(g)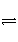
 2Z(g)。已知X2、Y2和Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.2 mol·L-1,当反应在一定条件下达到平衡时,各物质的浓度有可能是( )
2Z(g)。已知X2、Y2和Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.2 mol·L-1,当反应在一定条件下达到平衡时,各物质的浓度有可能是( )
A.Z为0.3 mol·L-1 B.Y2为0.4 mol·L-1
C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com