
【题目】用化学用语回答下列问题:
(1)写出下列物质在水中的电离方程式:
H2CO3 ______________________ NaHSO4 ___________________
(2)已知25 ℃时,两种弱酸的电离平衡常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,向NaCN溶液中通入少量CO2反应的离子方程式:_______________________________。
(3)已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O![]() HCl+HClO,HClO
HCl+HClO,HClO![]() H++ClO-,达到平衡后,由此说明在实验室可用排饱和食盐水收集Cl2的理由是_________________。
H++ClO-,达到平衡后,由此说明在实验室可用排饱和食盐水收集Cl2的理由是_________________。
(4)某温度下纯水中c(H+) = 2×10-7 mol/L,则此时溶液中的c(OH-) =_________。若温度不变,滴入稀盐酸使c(H+) = 5×10-6 mol/L,则此时溶液中的c(OH-) =___________。
【答案】H2CO3![]() HCO3-+H+、HCO3-
HCO3-+H+、HCO3-![]() H++CO32- NaHSO4==Na++H++SO42- CN- +CO2+H2O==HCN+HCO3- 饱和食盐水中NaCl电离出的Cl-,阻止了Cl2与水反应的正向进行,从而降低了氯气的溶解度 2×10-7 mol/L 8×10-9mol/L
H++CO32- NaHSO4==Na++H++SO42- CN- +CO2+H2O==HCN+HCO3- 饱和食盐水中NaCl电离出的Cl-,阻止了Cl2与水反应的正向进行,从而降低了氯气的溶解度 2×10-7 mol/L 8×10-9mol/L
【解析】
(1)H2CO3 为二元弱酸,分两步发生电离;
NaHSO4为强酸的酸式盐,在水溶液中完全电离为Na+、H+、SO42-。
(2)碳酸的第二步电离常数Ka2< Ka(HCN的电离常数),所以向NaCN溶液中通入少量CO2,碳酸只能发生第一步电离。
(3) Cl2+H2O![]() H++Cl- +HClO,饱和食盐水中NaCl电离出的Cl-,抑制了Cl2与水反应平衡的正向进行,从而抑制了氯气的溶解。
H++Cl- +HClO,饱和食盐水中NaCl电离出的Cl-,抑制了Cl2与水反应平衡的正向进行,从而抑制了氯气的溶解。
(4)纯水中,c(H+) = c(OH-),从而得出此时溶液中的c(OH-)。若温度不变,可求出水的离子积常数KW=2×10-7×2×10-7 =4×10-14,由c(H+) = 5×10-6 mol/L,可求出此时溶液中的c(OH-)。
(1)H2CO3 为二元弱酸,分两步发生电离,电离方程式为H2CO3![]() HCO3-+H+、HCO3-
HCO3-+H+、HCO3-![]() H++CO32-。答案为:H2CO3
H++CO32-。答案为:H2CO3![]() HCO3-+H+、HCO3-
HCO3-+H+、HCO3-![]() H++CO32-;
H++CO32-;
NaHSO4为强酸的酸式盐,在水溶液中完全电离为Na+、H+、SO42-,电离方程式为NaHSO4==Na++H++SO42-。答案为:NaHSO4==Na++H++SO42-;
(2)碳酸的第二步电离常数Ka2< Ka(HCN的电离常数),所以向NaCN溶液中通入少量CO2,碳酸只能发生第一步电离,反应的离子方程式为CN- +CO2+H2O==HCN+HCO3-。答案为:CN- +CO2+H2O==HCN+HCO3-;
(3) Cl2+H2O![]() H++Cl- +HClO,饱和食盐水中NaCl电离出的Cl-,抑制了Cl2与水反应平衡的正向进行,从而抑制了氯气的溶解。从而得出在实验室可用排饱和食盐水收集Cl2的理由是饱和食盐水中NaCl电离出的Cl-,阻止了Cl2与水反应的正向进行,从而降低了氯气的溶解度。答案为:饱和食盐水中NaCl电离出的Cl-,阻止了Cl2与水反应的正向进行,从而降低了氯气的溶解度;
H++Cl- +HClO,饱和食盐水中NaCl电离出的Cl-,抑制了Cl2与水反应平衡的正向进行,从而抑制了氯气的溶解。从而得出在实验室可用排饱和食盐水收集Cl2的理由是饱和食盐水中NaCl电离出的Cl-,阻止了Cl2与水反应的正向进行,从而降低了氯气的溶解度。答案为:饱和食盐水中NaCl电离出的Cl-,阻止了Cl2与水反应的正向进行,从而降低了氯气的溶解度;
(4)纯水中,c(H+) = c(OH-),从而得出此时溶液中的c(OH-)=2×10-7 mol/L。若温度不变,可求出水的离子积常数KW=2×10-7×2×10-7 =4×10-14,由c(H+) = 5×10-6 mol/L,可求出此时溶液中的c(OH-)=![]() =8×10-9mol/L。答案为:2×10-7 mol/L;8×10-9mol/L。
=8×10-9mol/L。答案为:2×10-7 mol/L;8×10-9mol/L。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.除去苯中的杂质苯酚可加入浓溴水后过滤
B.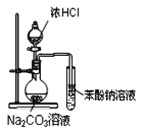 装置可证明酸性:盐酸>碳酸>苯酚
装置可证明酸性:盐酸>碳酸>苯酚
C.乙二酸与足量的酸性KMnO4溶液混合:5H2C2O4 + 2MnO4- + 6H+ =10CO2 ↑ + 2Mn2+ + 8H2O
D.鉴别![]() 和
和![]() 只能用金属钠
只能用金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法中正确的是
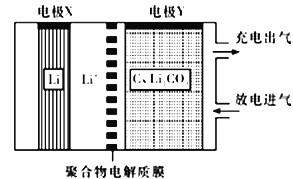
A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,每转移0.4mol电子,理论上阳极产生4.48L.CO2
C. 该电池放电时,每转移4mol电子理论上生成1molC
D. 该电池充电时,阳极反应式为C+2Li2CO3-4e-==3CO2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有可逆反应.2NO2(g)![]() N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
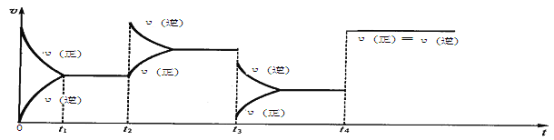
t2:_______________________________________________;
t3:_______________________________________________;
t4:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置可以制备无水氯化铁。下列有关说法正确的是( )
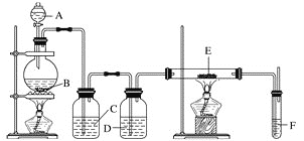
A. 烧瓶B中制备氯气的反应物为MnO2和稀盐酸
B. 装置C、D中分别盛有浓硫酸、饱和食盐水
C. 装置E和装置F之间需要增加一个干燥装置,才能制得无水氯化铁
D. 装置F的目的是检验有无氯气逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是

A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述与图象相对应的是
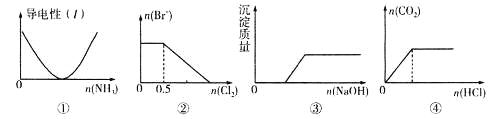
A.图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
B.图②表示向1 L l mol·L-1FeBr2溶液中通入Cl2时Br-物质的量的变化
C.图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化
D.图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com