
分析 由于硫酸是二元强酸,故25℃时,0.05mol•L-1H2SO4溶液中c(H+)=0.1mol/L,根据pH=-lgc(H+)来计算;
由于氢氧化钠是一元强碱,故0.01mol•L-1 NaOH溶液c(OH-)=0.1mol/L,然后根据c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$求出氢离子浓度,再根据pH=-lgc(H+)来计算.
解答 解:由于硫酸是二元强酸,故25℃时,0.05mol•L-1H2SO4溶液中c(H+)=0.1mol/L,故pH=-lgc(H+)=-lg0.1=1;
由于氢氧化钠是一元强碱,故0.01mol•L-1 NaOH溶液c(OH-)=0.1mol/L,故溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,故溶液的pH=-lgc(H+)=-lg10-12=12.
故答案为:1;12.
点评 本题考查了溶液pH的有关计算,应注意的是溶液的pH=-lgc(H+)公式的运用.


科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ③④⑥ | C. | ②④⑤ | D. | ②③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含有碳元素的化合物都是有机化合物 | |
| B. | 所有的有机化合物均难溶解于水 | |
| C. | 有机物组成元素较少,而有机物的种类繁多 | |
| D. | 完全燃烧只生成CO2和H2O的有机物是烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
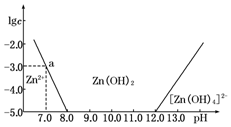
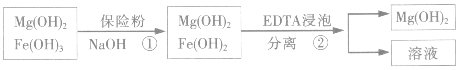
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
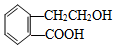 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.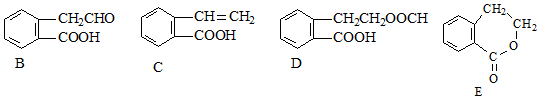
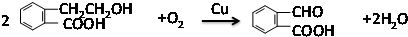 ,反应类型:氧化反应
,反应类型:氧化反应 ,反应类型:酯化反应
,反应类型:酯化反应 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
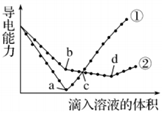
| A. | b点,水电离产生的c(H+)<10-7mol/L | B. | ①代表滴加H2SO4溶液的变化曲线 | ||
| C. | a、d两点对应的溶液均显中性 | D. | c点,两溶液中含有相同量的 OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
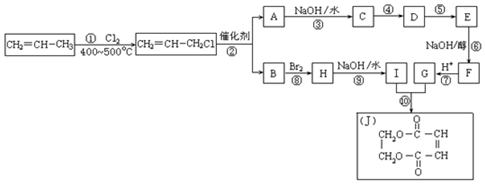
 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com