

| A�� | M�дﵽƽ�����ͨ��һ�����ĺ�����ƽ�ⲻ�ƶ���������������ܶȲ��� | |
| B�� | ��x��y=1��2����ƽ��ʱ��M�е�ת���ʣ�A��B | |
| C�� | ��x��y=1��3����M�зų�����172.8 kJʱ��A��ת����Ϊ90% | |
| D�� | N�дﵽƽ�����ͨ��һ�����ĺ���ʱ��v��������v���棩 |
���� A��M���Ǻ��º��������µķ�Ӧ���ﵽƽ��״̬����ͨ��һ������He��A��B��C��Ũ�Ȳ��䣬��ƽ�ⲻ�ƶ������ܻ������������������������䣻
B�����x��y=1��3�����ߵ�ת������ȣ����x��y=1��2����B��ת���ʴ�
C����Ŀ���Ȼ�ѧ����ʽ������Ϊ1molA��ȫ��Ӧ������192 kJ������ʵ�ʷų�����������μӷ�Ӧ��A�����ʵ�����������ʾ��ת���ʽ����жϣ�
D��N���Ǻ�ѹ�����µķ�Ӧ������He���������������A��B��C��˵ѹǿ��С��ƽ�������ƶ���
��� �⣺A��M���Ǻ��º��������µķ�Ӧ���ﵽƽ��״̬����ͨ��һ������He��A��B��C��Ũ�Ȳ��䣬��ƽ�ⲻ�ƶ������ܻ������������������������䣬�����ڻ�������ܶ�����A����
B�����x��y=1��3�����ߵ�ת������ȣ����x��y=1��2����B��ת���ʴ�M�е�ת���ʣ�A��B����B����
C����Ŀ���Ȼ�ѧ����ʽ�����壺��1molA��ȫ��Ӧ������192 kJ����M�зų�����172.8 kJʱ���μӷ�Ӧ��A�����ʵ���Ϊ$\frac{172.8kJ}{192kJ}$��1mol=0.9mol�������A�����ʵ���δ֪��������A��ת���ʣ���C����
D��N���Ǻ�ѹ�����µķ�Ӧ������He���������������A��B��C��˵ѹǿ��С��ƽ�������ƶ�����v��������v���棩����D��ȷ��
��ѡD��
���� ���⿼�黯ѧƽ����㼰��������Ի�ѧƽ���ƶ�Ӱ�죬Ϊ��Ƶ���㣬���ؿ���ѧ�������ж���������ȷM�Ǻ��ݡ�N�Ǻ�ѹ��Ӧ�ǽⱾ��ؼ���ע�⣺��������м���ķ�Ӧ������ʵ���֮�ȵ����������֮��ʱ����Ӧ���ת������ȣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
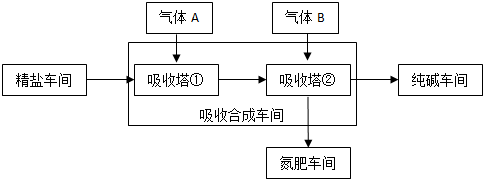
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | 1 | 2 | 3 | 4 |
| ��Ӧ��Ͷ���� ��ʼ̬�� | 1mol CO2 3mol H2 | 1mol CH3OH 1mol H2O | 2mol CH3OH 2mol H2O | 0.8mol CO2 2.4mol H2 0.2mol CH3OH 0.2mol H2O |
| CH3OH��ƽ��Ũ��/mol•L-1 | c1 | c2 | c3 | c4 |
| ��Ӧ�������仯 | �ų� x kJ | ����y kJ | ����z kJ | �ų� w kJ |
| ��ϵѹǿ/Pa | p1 | p2 | p3 | p4 |
| ��Ӧ��ת���� | a1 | a2 | a3 | a4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
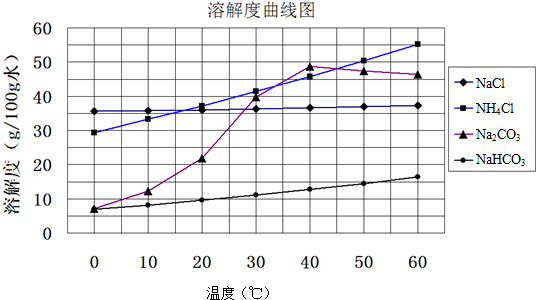
 ����Һ�У���ӦA+2B?C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc��A��=0.100mol/L��c��B��=0.200mol/L��c��C��=0mol/L����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ��
����Һ�У���ӦA+2B?C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc��A��=0.100mol/L��c��B��=0.200mol/L��c��C��=0mol/L����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ������I��Ӧ�������ı��������¶ȣ���÷�Ӧ��H��0 | |
| B�� | ����II��Ӧ�������ı��ǽ���ѹǿ | |
| C�� | ��Ӧ��ʼ��a��ʱv��H2��=1mol•L-1•min-1 | |
| D�� | �����¶Ȳ��䣬����ƽ�������������С��1L�����´�ƽ��ʱ��2 mol•L-1��c��CH3OH����$\frac{8}{3}$mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
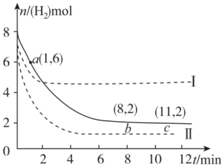
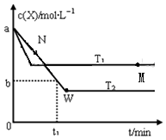 �ں����ܱ�������ͨ��X��������Ӧ��2X��g��?Y��g�����¶�T1��T2��X�����ʵ���Ũ��c��x����ʱ��t�仯��������ͼ��ʾ������������ȷ���ǣ�������
�ں����ܱ�������ͨ��X��������Ӧ��2X��g��?Y��g�����¶�T1��T2��X�����ʵ���Ũ��c��x����ʱ��t�仯��������ͼ��ʾ������������ȷ���ǣ�������| A�� | M��ʱ�ټ���һ������X��ƽ���X��ת�������� | |
| B�� | T2�£���0��t1ʱ���ڣ�v��Y��=$\frac{a-b}{{t}_{1}}$mol/��L•min�� | |
| C�� | M�������Ӧ����v��С��N����淴Ӧ����v�� | |
| D�� | �÷�Ӧ���е�M�����յ�����С�ڽ��е�W��ų������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢߢ� | B�� | �٢ۢݢߢ� | C�� | �٢ۢݢ� | D�� | �ڢܢݢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��NaOH 0.2mol | B�� | Ũ��2mol/L | ||
| C�� | ��NaOH 4g | D�� | ���ʵ�����������ԭ��Һ��ͬ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com