
| 步骤 | 操作 | 现象 |
| I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
 SO32- +
SO32- + =
= F e2+ +
F e2+ + +
+

| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| III | 向1 mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
 Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3②2Fe3+ + SO32- +H2O = 2Fe2+ +SO42-+2H+(3)FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应”(4)①a ②H2SO3
Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3②2Fe3+ + SO32- +H2O = 2Fe2+ +SO42-+2H+(3)FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应”(4)①a ②H2SO3 H++HSO3—;HSO3—
H++HSO3—;HSO3— H++SO32—,SO32—与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色
H++SO32—,SO32—与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色 Fe(OH)3+3H+,加入Na2SO3后,SO32-与H+反应生成SO2,使溶液中c(H+)下降,平衡正向移动,促进水解进行②2Fe3++SO32-+H2O = 2Fe2++SO42+2H+②由题意知铁元素的化合价降低,生成亚铁离子,硫元素化合价升高生成硫酸根离子,故反应方程式2Fe3+ + SO32- +H2O = 2Fe2+ +SO42-+2H+(3)由查阅到的资料可知墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色,也可产生“丁达尔现象”故无法确定是否为Fe(OH)3(4)①亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,这是亚铁离子的特征反应,故a正确 ②H2SO3分步电离生成SO32—,SO32—与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色,H2SO3
Fe(OH)3+3H+,加入Na2SO3后,SO32-与H+反应生成SO2,使溶液中c(H+)下降,平衡正向移动,促进水解进行②2Fe3++SO32-+H2O = 2Fe2++SO42+2H+②由题意知铁元素的化合价降低,生成亚铁离子,硫元素化合价升高生成硫酸根离子,故反应方程式2Fe3+ + SO32- +H2O = 2Fe2+ +SO42-+2H+(3)由查阅到的资料可知墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色,也可产生“丁达尔现象”故无法确定是否为Fe(OH)3(4)①亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,这是亚铁离子的特征反应,故a正确 ②H2SO3分步电离生成SO32—,SO32—与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色,H2SO3 H++HSO3—,HSO3—
H++HSO3—,HSO3— H++SO32—,Fe2+ + SO32- = FeSO3。
H++SO32—,Fe2+ + SO32- = FeSO3。

 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:不详 题型:问答题
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
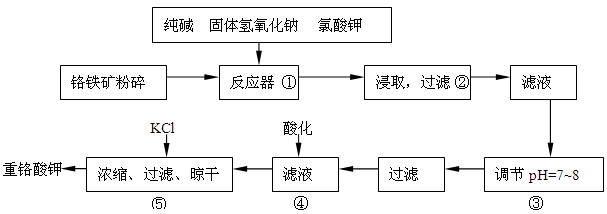
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
C.N(NO2)3( )既有氧化性又有还原性 )既有氧化性又有还原性 |
| D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

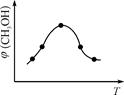
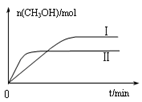
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
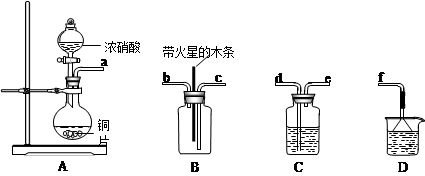
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应中KMnO4被氧化 |
| B.氧化产物与还原产物的物质的量之比为2﹕5 |
| C.每生成1 mol Cl2时,反应中转移的电子为2 mol |
| D.每消耗16 mol HCl时,其中做氧化剂的HCl是10 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.产物中n[Cu(NO3)2]∶n[CuSO4]=1∶1 |
| B.参加反应的n(Cu2S)∶n(HNO3)=1∶5 |
| C.反应中Cu2S既作氧化剂,又作还原剂 |
| D.1 mol Cu2S参加反应时有8 mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com