
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
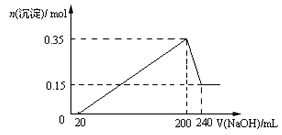
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
【答案】D
【解析】试题分析:从图象中看到,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后有剩余,此时发生的反应为:H2so4+2NaOH=Na2so4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3;
A、当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,n(Mg)=n[Mg(OH)2]=0.15mol,
m(Mg)=0.15mol×24gmol-1=3.6g,n(Al)=n[Al(OH)3]=0.35mol-0.15mol=0.2mol,m(Al)=0.2mol×27gmol-1=5.4g,所以镁和铝的总质量为9g,A项正确,B项正确。C.从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,则此过程消耗n(NaOH)=n[Al(OH)3]=0.2mol,c(NaOH)="0.2mol÷0.04" L=5molL-1,C项正确;D、由Mg+H2so4=Mgso4+H2↑,2Al+3H2so4=2Al2(so4)3+3H2↑可以计算出生成n(H2)=0.45mol,标准状况下V(H2)=0.45mol×22.4Lmol-1=10.08L,D项错误。答案选D。


科目:高中化学 来源: 题型:
【题目】C1O2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得C1O2:![]() ,下列说法中正确的是( )
,下列说法中正确的是( )
A. 在反应中H2C2O4既不是氧化剂也不是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 1 mol KClO3参加反应有2 mol电子转移
D. KClO3在反应中是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.
请根据所学知识的回答:
(1)浓度为0.1mol/L的8种溶液:①HNO3 ②H2SO4③HCOOH ④Ba(OH)2⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl 溶液pH值由小到大的顺序是(填写编号) .
(2)B为0.1molL﹣1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请用离子方程式表示其原因: .
(3)在0.10molL﹣1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=(已知Ksp[Cu(OH)2]=2.2x10﹣20).若在0.10molL﹣1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制取无水氯化铁的实验装置图。请回答下列问题:
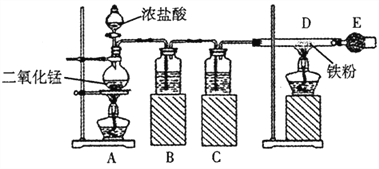
已知:氯化铁易潮解。
(1)烧瓶中发生反应的化学方程式是_________________;
(2)B瓶中的溶液是_________________,C瓶中溶液的作用是_________________。
(3)干燥管E中盛有碱石灰,其作用是_________________。
(4)开始实验时,应先点燃_________________(填字母)处的酒精灯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2气体通入下列澄清溶液中,最终仍为澄清溶液的是( )
A. 偏铝酸钠溶液 B. 氯化钡溶液 C. 含有氨水的NaCl饱和溶液 D. 饱和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是( )
A.Na+、Mg2+、OH-、Br-B.H+、Fe2+、SO42-、NO3-
C.K+、NH4+、CO32-、OH-D.Ca2+、Al3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeOCr2O3、SiO2等)制备,制备流程如图所示:

已知:a.步骤①的主要反应为: 2FeOCr2O3+4Na2CO3+ 7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2 b. 2CrO42-+2H+
4Na2CrO4+Fe2O3+4CO2+7NaNO2 b. 2CrO42-+2H+ ![]() Cr2O72-+H2O
Cr2O72-+H2O
下列说法正确的是
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8L(标况下) CO2共转移14mol电子
C. 步骤④若调节滤液2的pH使之变大,则有利于生成Cr2O72-
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7溶解度小于Na2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A.NA个O2分子与NA个氖分子的质量比是4∶5
B.11.2L任何气体有可能为0.5mol
C.12g12C质子数6NA
D.常温常压下,4.4gCO2为0.1NA个CO2分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com