
分析 (1)Fe2+的水解程度大于NH4+,水解程度越大,离子浓度越小,Fe2+和NH4+水解溶液显酸性;
(2)溶液pH约为7,c(OH-)=10-7mol/L,根据Ksp(Fe(OH)3=c(Fe3+)×c3(OH-)计算;KMnO4将Mn2+氧化为固相的+4价锰的化合物,则生成二氧化锰;
(3)根据化合价的变化判断氧化剂;
(4)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,据此判断.
解答 解:(1)硫酸铁铵[NH4Fe(SO4)2•12H2O]溶于水形成的溶液中,Fe2+和NH4+水解溶液显酸性,Fe2+的水解程度大于NH4+,水解程度越大,离子浓度越小,所以c(NH4+)>c(Fe2+),硫酸根离子不水解,浓度最大,所以溶液中离子浓度关系c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);
故答案为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);
(2)溶液pH约为7,c(OH-)=10-7mol/L,Ksp(Fe(OH)3=c(Fe3+)×c3(OH-)=4.0×10-38,则c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1{0}^{-7})^{3}}$=4.0×10-17mol/L;KMnO4将Mn2+氧化为固相的+4价锰的化合物,则生成二氧化锰,其反应的离子方程式为:2MnO4-+3Mn2++2H2O=5MnO2+4H+;
故答案为:4.0×10-17;2MnO4-+3Mn2++2H2O=5MnO2+4H+;
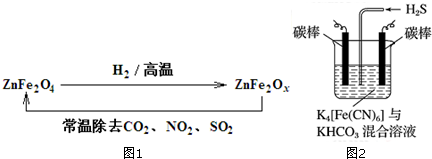
(3)新型纳米材料ZnFe2OX可由化合物ZnFe2O4经高温还原制得,故ZnFe2OX和SO2反应得到ZnFe2O4过程中铁的化合价升高,也可由①计算可知,故ZnFe2OX作还原剂,则SO2作氧化剂;
故答案为:SO2;
(4)电解时,阳极的电极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3-,电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,由于CO32-的水解程度大于HCO3-,所以碱性增强,则pH变大;
故答案为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;变大.
点评 本题考查了离子浓度大小比较、氧化还原反应、溶度积常数的计算及电解等,题目综合性较强,注重对学生综合能力的考查,把握习题中的信息及迁移应用为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 苯的最简式:C6H6 | B. | 乙烯分子的结构简式为:CH2CH2 | ||
| C. | 一氯甲烷的电子式为: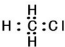 | D. | 2-甲基丁烷的键线式: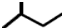 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛溶液浸泡生物样本 | |
| B. | 强酸、强碱对蛋白质的腐蚀 | |
| C. | 重金属盐使人和动物中毒 | |
| D. | 浓的硫酸铵溶液使鸡蛋清溶液析出固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H2<△H1<△H3 | C. | △H1=△H2=△H3 | D. | △H1>△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 合成
合成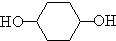
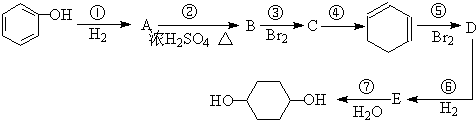
 C、
C、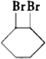
 $→_{△}^{浓硫酸}$
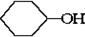
$→_{△}^{浓硫酸}$ +H2O⑦
+H2O⑦ +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$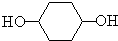 +2NaBr.
+2NaBr. 能发生哪些反应③④⑥(填序号)
能发生哪些反应③④⑥(填序号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com