
| A. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 | |
| C. | 2SO2(g)+O2(g)═2SO3(g)△H1;2SO3(g)═O2(g)+2SO2(g)△H2 | |
| D. | 已知反应:C(金刚石,s)═C(石墨,s)△H<0,C(金刚石,s)+O2(g)═CO2(g)△H1;C(石墨,s)+O2(g)═CO2(g)△H2 |
分析 物质由固体变成液态,由液态变成气态,都必定吸收热量;而由液态变成固态,由气态变成液态,或由气态直接变成固态,则放出热量.因此在进行反应热计算或大小比较时,应特别注意各反应物或生成物的状态,焓变应是带正负号进行比较大小,依据盖斯定律分析判断.
解答 解:A、依据盖斯定律氢气和氧气反应生成液态水放热多,所以△H1>△H2,故A正确;
B、依据盖斯定律固体硫变化为气态硫需要吸收热量,所以△H1<△H2 ,故B错误;
C、二氧化硫转化为三氧化硫是放热反应,三氧化硫分解成二氧化硫和氧气是吸热反应,所以△H1<△H2 ,故C错误;
D、由反应C(金刚石,s)+O2(g)═CO2(g)△H1;C(石墨,s)+O2(g)═CO2(g)△H2,根据盖斯定律可知:△H1-△H2<0,所以△H1<△H2 ,故D错误;
故选A.
点评 本题考查了反应热的比较,主要是盖斯定律的具体应用,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
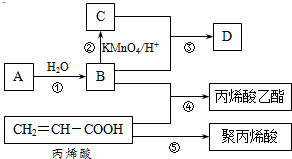 A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25g/L;B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示v(反应条件已省略):
A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25g/L;B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示v(反应条件已省略): ,C中官能团的名称为羧基.
,C中官能团的名称为羧基. ,加聚反应.
,加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能燃烧,生成 CO2 和 H2O | |
| B. | 邻二甲苯另有三种属于芳香烃的同分异构体 | |
| C. | 乙烯和乙炔易发生加成反应,邻二甲苯能发生取代反应 | |
| D. | 乙烯和乙炔易使酸性 KMnO4 溶液褪色,而邻二甲苯不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被保护的金属与电源的正极相连 | |
| B. | 被保护的金属表面上不发生氧化反应,也不发生还原反应 | |
| C. | 在被保护的金属表面上发生氧化反应 | |
| D. | 被保护的金属与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

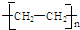 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CH4中含有分子的数目为NA | |
| B. | 标准状况下,2.24 L Cl2与足量铁反应,转移电子的数目为0.3NA | |
| C. | 常温常压下,46 g NO2和N2O4混合气体中含有的原子数为3NA | |
| D. | 标准状况下,2.24 LCO2与足量镁反应,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实验次数 | 酸的温度 | 碱的温度 | 反应最高温度 |
| 1 | 21.5℃ | 20.5℃ | 24.3℃ |
| 2 | 21.5℃ | 21.5℃ | 25.0℃ |
| 3 | 16.0℃ | 18.5℃ | 21.5℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com