
| A. | 在汽油中加入乙醇热值改变 | |
| B. | 秸秆燃烧是造成雾霾的原因之一 | |
| C. | 用牺牲阴极的方法可以保护金属 | |
| D. | 自行车钢架生锈主要是电化学腐蚀所致 |
分析 A、汽油和乙醇的成分不一样,燃烧反应的燃烧热不一样;
B、PM2.5是造成雾霾的原因之一;
C、原电池的负极金属,电解池的阳极金属都易被腐蚀;
D、能构成原电池的腐蚀属于电化学腐蚀.
解答 解:A、汽油和乙醇的成分不一样,燃烧反应的燃烧热不一样,在汽油中加入乙醇热值改变,故A错误;
B、PM2.5是造成雾霾的原因之一,秸秆燃烧会产生温室效应气体二氧化碳以及其他的有毒气体,不是造成雾霾的原因,故B错误;
C、原电池的负极金属,用牺牲阴极的阳极保护方法可以保护原电池的正极金属,故C正确;
D、铁和碳遇到合适的电解质溶液能构成原电池,属于电化学腐蚀,故D正确;
故选AB.
点评 本题考查了物质的性质、金属的腐蚀等知识点,明确金属的化学腐蚀和电化学腐蚀的判断方法即金属防护知识是关键.


科目:高中化学 来源: 题型:选择题
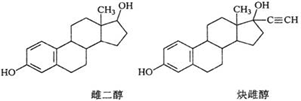
| A. | 能与Na、NaOH溶液、Na2CO3溶液反应 | |
| B. | 能发生加成反应、取代反应、消去反应 | |
| C. | 该分子中所有碳原子不可能在同一个平面内 | |
| D. | 可与FeCl3溶液发生显色反应,但不能与O2发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
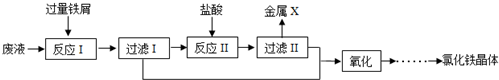
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
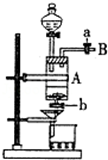 三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.
三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯为纯净物;聚乙烯为混合物 | |
| B. | 等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 乙烯的化学性质比聚乙烯活泼 | |
| D. | 乙烯和聚乙烯都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
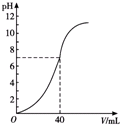 用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )| A. | 0.5 mol•L-1 100 mL | B. | 0.5 mol•L-180 mL | ||
| C. | 1 mol•L-160 mL | D. | 1 mol•L-180 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
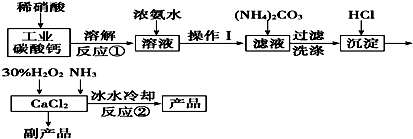
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com