
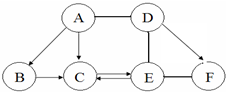
 如图 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,D、E、F 均由三种元素组成,且物质类别各不相同.“→”表示物质间的转化关系,“-”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).回答下列问题:
如图 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,D、E、F 均由三种元素组成,且物质类别各不相同.“→”表示物质间的转化关系,“-”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).回答下列问题:分析 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,则A为Fe2O3,由A、B、C之间转化可知B为CO2,C为H2O,D、E、F 均由三种元素组成,且物质类别各不相同,D能与氧化铁反应,则D为酸,由相互反应可知,E为碱、F为盐符合转化,则D为硫酸、E为NaOH、F为CuSO4符合转化关系.
解答 解:A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,则A为Fe2O3,由A、B、C之间转化可知B为CO2,C为H2O,D、E、F 均由三种元素组成,且物质类别各不相同,D能与氧化铁反应,则D为酸,由相互反应可知,E为碱、F为盐符合转化,则D为硫酸、E为NaOH、F为CuSO4符合转化关系.
(1)由上述分析可知,C为H2O、E为NaOH,故答案为:H2O;NaOH;
(2)按化合物组成的差异分类,F属于盐,故答案为:盐;
(3)A→B的化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)化学反应中元素的化合价发生改变的反应叫氧化还原反应,一定不是氧化还原反应的基本反应类型是:复分解反应,故答案为:复分解反应.
点评 本题考查无机物推断,注意为初中常见物质,属于猜测验证型题目,需要学生熟练掌握元素化合物知识,难度不大.


科目:高中化学 来源: 题型:填空题
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②⑤ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:7 | B. | 1:5 | C. | 1:8 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>H2S | ||
| C. | Fe3+>Cl2>H2S>I2. | D. | Cl2>I2>Fe3+>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol CH3+(碳正离子)中含有质子数为8NA | |
| B. | 6.4gCu与足量的硫反应,转移电子数为0.2 NA | |
| C. | 标准状况下,将分子总数为NA的NH3和HCl的充分混合后,所得混合气体体积越为22.4L | |
| D. | 7.8g Na2O2中含有的离子总数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com