
| 0.4mol |
| 2L |
| 0.4×0.4 |
| 0.6 |
 ,故平衡常数K1<K2=K3,
,故平衡常数K1<K2=K3, ;K1<K2=K3;
;K1<K2=K3;

科目:高中化学 来源: 题型:阅读理解

| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 2 | 4 | 0.9 | t |
查看答案和解析>>
科目:高中化学 来源:2012届山东省临沂市苍山县高三上学期期末检测化学试卷 题型:填空题
(17分)随着世界工业经济的发展、人口的剧增,全球能源紧缺面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为: C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1
C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1
①该反应的平衡常数表达式为 。
②下列措施中,不能提高碳的转化率的是 (填字母序号)
| A.容器的体积不变,增加水蒸气的物质的量 | B.缩小容器的体积,增大压强 |
| C.及时将水煤气从容器中移走 | D.其他条件不变,升高温度 |
 ③又知C(s)+CO2(g) 2CO(g) △H=+172.5kJ·mol-1
③又知C(s)+CO2(g) 2CO(g) △H=+172.5kJ·mol-1 则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为 。
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为 。 (2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇作为一种可再生能源燃料,可用于燃料电池。下图是甲醇燃料的原理示意图:
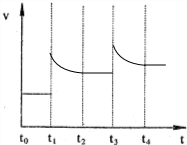
(2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇作为一种可再生能源燃料,可用于燃料电池。下图是甲醇燃料的原理示意图:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省临沂市苍山县高三上学期期末检测化学试卷 题型:填空题
(17分)随着世界工业经济的发展、人口的剧增,全球能源紧缺面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
 C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1
C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1
①该反应的平衡常数表达式为 。
②下列措施中,不能提高碳的转化率的是 (填字母序号)
A.容器的体积不变,增加水蒸气的物质的量 B.缩小容器的体积,增大压强
C.及时将水煤气从容器中移走 D.其他条件不变,升高温度
 ③又知C(s)+CO2(g)
2CO(g) △H=+172.5kJ·mol-1
③又知C(s)+CO2(g)
2CO(g) △H=+172.5kJ·mol-1
 则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为
。
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为
。
 (2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇作为一种可再生能源燃料,可用于燃料电池。下图是甲醇燃料的原理示意图:
(2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇作为一种可再生能源燃料,可用于燃料电池。下图是甲醇燃料的原理示意图:
①a处通入的是 (填物质名称),该电池工作过程中,H+的移动方向
为从 到 (填“左”或“右”)
②该电池正极反应式为 。
③若用该电池提供的电能电解600ml 0.2mol·L-1NaCl溶液,设有0.01molCH3OH完全放电,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解时阴极反应式为 ,电解结束后所得溶液的pH= 。若向电解后的溶液加入适量的醋酸至溶液的pH恰好等于7(反应前后忽略溶液体积的变化),则此时溶液中c(Na+):c(CH3COO-)= 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:填空题
(13分)煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g)△H=131.5kJ·mol-1
CO(g)+H2(g)△H=131.5kJ·mol-1
①下列措施中,不能提高碳的转化率的是 (填字母序号)。
a.容器的容积不变,增加水蒸汽的物质的量
b.缩小容器的容积,增大压强
c.及时将水煤气从容器中移走
d.其他条件不变,升高温度
②又知,C(s)+CO2(g) 2CO(g)△H=172.5kJ·mol-1
2CO(g)△H=172.5kJ·mol-1
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为 。
CO2(g)+H2(g)的焓变(△H)为 。
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2 CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
 ①a处通入的是
(填物质名称),左侧电极上发
①a处通入的是
(填物质名称),左侧电极上发
生 (填“氧化”或“还原”)反应。
②该电池工作过程中,H+的移动方向为从 到
(填“左”或“右”)
③该电池正极反应式为 。
④若用该电池提供的电能电解60mL NaCl溶液,设有
0.01molCH3OH完全放电,NaCl足量,且电解产生的
Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH= 。
(3)将等量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中进行如下反应,
CO(g)+H2O(g) CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:
CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:

①在实验1中,以v(CO2)表示该反应的反应速率为 mol·L-1·min-1;
②在实验2中,t 5。(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com