
【题目】水中加入下列溶液对水的电离平衡不产生影响的是( )
A.NaHSO4溶液
B.NaCl溶液
C.KAl(SO4)2溶液
D.KF溶液
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】已知反应 2NH3N2+3H2 , 在某温度下的平衡常数为0.25,那么,在此条件下,氨的合成反应 ![]() N2+
N2+ ![]() H2NH3 的平衡常数为( )
H2NH3 的平衡常数为( )
A.4
B.2
C.1
D.0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在西部大开发中,将投巨资兴建“西气东输”工程,将西部蕴藏的丰富资源通过管道输送到东部地区。这里所指的“西气”的主要成分是
A. CH4B. COC. H2 D. NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)2Z(g)+M(s),5min后达到平衡,此时生成0.2mol Z.下列说法正确的是( )
A.若将容器压缩时,正逆反应速率均不变
B.5 min内平均反应速率v(X)=0.02 mol/(Lmin)
C.向平衡后的体系中加入l molM(s),平衡向逆反应方向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
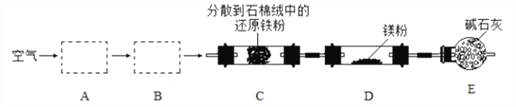
下列说法正确的是
A. 装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B. 装置 E 中碱石灰的作用是吸收尾气
C. 实验时, 应先加热 C,通入一段时间空气后再加热D
D. 若去掉装置 C,对产品纯度无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】定量分析是化学实验中重要的组成部分. Ⅰ.中和热的测定:
(1)在实验室中,用50mL 0.40mol/L的盐酸与50mL 0.50mol/L的NaOH溶液反应测定和热.假设此时溶液密度均为1g/cm3 , 生成溶液的比容热c=4.18J/(g℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式 (写出最后结果)△H=KJ/mol.
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量.请写出表示该反应中和热的热化学方程式 .
(3)滴定原理为:(用离子方程式表示).
(4)滴定时,KMnO4溶液应装在(填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为 .
(5)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为mL. 
(6)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如表:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(7)写出计算H2C2O4的物质的量浓度的最简表达式:C=mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究. 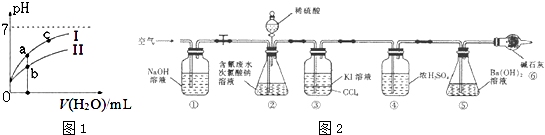
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 |
(1)NaCN溶液呈碱性的原因是(用离子方程式表示)
(2)如图1表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度
的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:
CN﹣+CO2+H2O=HCN+CO32﹣
C.图象中a、c两点处的溶液中 ![]() 相等(HR代表HCOOH或HCN)
相等(HR代表HCOOH或HCN)
D.图象中a点酸的总浓度小于b点酸的总浓度
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为 .
(4)探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用如图2所示装置进行实验.将CN﹣的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4 , 关闭活塞.
已知装置②中发生的主要反应依次为:
CN﹣+ClO﹣═CNO﹣+Cl﹣
2CNO﹣+2H++3C1O﹣═N2↑+2CO2↑+3C1﹣+H2O
处理含CN﹣废水时,如用NaOH溶液调节pH至9时,此时c(CN﹣)c(HCN)(填“>”、“<”或“=”)
(5)①和⑥的作用是 .
(6)反应结束后,缓缓通人空气的目的是 .
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置反应前后的质量(从装置①到⑥中选择,填装置序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.离子化合物中可能存在共价键
B.原子晶体中一定存在共价键
C.分子晶体中一定存在共价键
D.含有离子键的化合物形成的晶体一定是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,两个等体积的干燥圆底烧瓶中分别充满:①NH3 , ②NO2 , 进行喷泉实验.经充分反应后,瓶内溶液的物质的量浓度为( ) 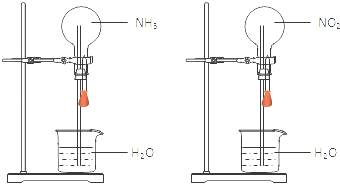
A.①>②
B.①<②
C.①=②
D.不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com