
【题目】下列说法中不正确的是( )
A.鉴别氢氧化铝胶体(无色)和食盐水,可以不用任何试剂
B.鉴别白糖水和食盐溶液,可以不用任何试剂
C.鉴别粉笔末与水、豆油与水组成的浊液,可以不用任何试剂
D.鉴别氯化钠溶液与硫酸铜两种溶液,可以不用任何试剂
科目:高中化学 来源: 题型:
【题目】铬是重要的战略物质之一,由于具有质硬,耐磨,耐高温,抗腐蚀性等特性,所以在工业上应用比较广泛,在冶金工业上主要用铬铁矿(Cr2O3 、FeO、SiO2 、Al2O3 等,其它杂质不参加反应)生产铬和铁等金属。流程如下:

已知:2Cr2O3+3O2+4Na2CO3![]() 4Na2CrO4+4CO2;部分物质的溶解度(单位g)
4Na2CrO4+4CO2;部分物质的溶解度(单位g)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
Na2CO3 | 7.0 | 13 | 29 | 40 | 49 | 46 | 44 |
NaHCO3 | 6.9 | 8.5 | 9.6 | 11.1 | 12.7 | 14.4 | 16.9 |
Na2Cr2O7 | 161 | 170 | 183 | 198 | 218 | 240 | 265 |
(1)粉碎的目的
(2)写出焙烧时含铝物质发生的化学反应方程式_______________________________;
(3)操作4是_______________________,沉淀3含有的物质有_____________________;
(4)写出生成沉淀5的离子方程式_____________________________________________;
(5)整个流程可以循环使用的物质有___________________________;
(6)最后一步制备金属铬的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周辉《清波杂志》卷十二:信州铅山胆水自山下注,势若瀑布,用以浸铜,铸冶是赖,虽干溢系夫旱涝,大抵盛于春夏,微于秋冬。古传一人至水滨,遗匙钥,翌日得之,已成铜矣。这里的胆水是指
A. CuSO4 溶液 B. FeSO4 溶液 C. 氨水 D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将2mol气体A和1mol气体B充入容积为2L的恒容密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g),2min时化学反应达到平衡(温度仍为t℃),此时B还有 0.6mol,并测得C的浓度为0.6mol/L。请回答下列问题:
xC(g),2min时化学反应达到平衡(温度仍为t℃),此时B还有 0.6mol,并测得C的浓度为0.6mol/L。请回答下列问题:
(1)判断该反应达到平衡的标志是______。
a.容器中的压强保持不变 b.A的生成速率与B的消耗速率之比为2:1
c.容器内混合气体的密度保持不变 d.A的百分含量保持不变
e.B和C的物质的量浓度之比为1:x
(2)x=___, 从反应开始到达到平衡时,用B表示该反应的平均反应速率v(B)=____;
(3)化学反应达到平衡时,A的转化率为_____。
(4)某化学兴趣小组同学为了研究上述反应的反应速率,他们将A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的曲线。
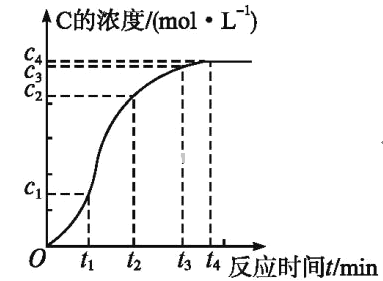
在O~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的时间段是____,从反应速率的变化可看出该反应可能是____(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2和O2反应生成2molSO3时,放出的热量为QKJ,在1L的密闭容器中进行反应 2SO2(g)+O2(g)![]() 2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是
2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是
A. 反应达到平衡时放出的热量为0.1QKJ
B. 某时刻,SO3的物质的量为0.28 mol,则SO2的转化率为40%
C. 某时刻,SO2、O2、SO3的物质的量分别为0.3mol、0.15mol、0.15mol
D. 某时刻,SO3的浓度可能为0.4mol-1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
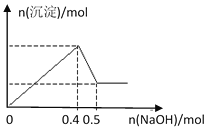
A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学教材中元素周期表的一部分,其中标出A~R 15种元素,试根据它们回答下列问题(填具体元素符号或化学式):

(1)化学性质最不活泼的是____,原子半径最小的是(除稀有气体元素)___属于过渡元素的是____(填A~R中的代号)。
(2)最高价氧化物对应的水化物中酸性最强的是_____,单质中氧化性最强的是________,第三周期元素形成的简单离子中半径最小的是______。
(3)F与K形成的化合物溶于水发生电离,所破坏的化学键为______。
(4)Q在元素周期表中的位置是_____,B、C可形成化合物B2C,该化合物的核外电子总数为_____。
(5)P的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物的离子方程式:____________。
(6)元素E与元素F相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.与酸反应时,每个F原子比每个E原子失电子数多
b.E的氢化物比F的氢化物稳定
c.E和F的单质与水反应E较剧烈
d.最高价氧化物对应水化物碱性E比F强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
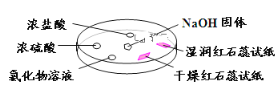
选项 | 实验现象 | 解释 |
A | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是MgCl2溶液 |
D | 浓盐酸附近产生白烟 | NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某太阳能电池的工作原理如图所示。下列说法正确的是( )
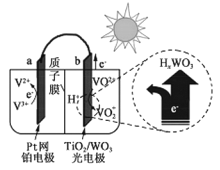
A. 硅太阳能电池供电原理与该电池相同
B. 光照时, H+由a极区经质子交换膜向b极区迁移
C. 光照时,b极的电极反应式为 VO2+-e-+H2O=VO2++2H+
D. 夜间无光照时,a极的电极反应式为V3++e-=V2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com