
石墨烯(如图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙).
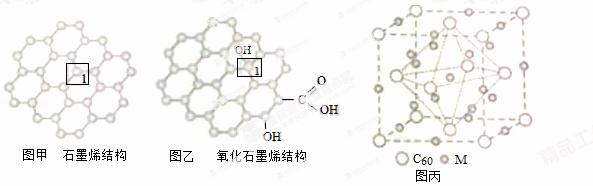
(1)图甲中,1号C与相邻C形成σ键的个数为 _________ .
(2)图乙中,1号C的杂化方式是 _________ ,该C与相邻C形成的键角 _________ (填“>”“<”或“=”)图甲中1号C与相邻C形成的键角.
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有 _________ (填元素符号).
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为 _________ ,该材料的化学式为 _________ .
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列化学用语中,正确的是
A. NH4+的水解反应离子方程式:NH4+ + H2O NH3·H2O + H+
NH3·H2O + H+
B.在AgCl悬浊液中加入KI溶液充分振荡:Ag+ + I- = AgI↓
C.镀铜时,阳极的电极反应式为: Cu2++2e- == Cu
D.某反应⊿H<0,则该反应在任意条件下均可自发进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。工艺流程如下:

(注:NaCl熔点为801 ℃;AlCl3在181 ℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①_____________和
②___________________。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有_____________;
固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________________。
(3)在用废碱液处理A的过程中,所发生反应的离子方程式为_____________。
(4)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产硫酸的流程图如下:

请回答下列问题:
(1)早期生产硫酸以黄铁矿为原料,但现在工厂生产硫酸以硫黄为原料,理由是________________________________________________________________________。
(2)在气体进入催化反应室前需净化的原因是_________________________ ________
________
_____________________ ___________________________________________________。
___________________________________________________。
(3)在催化反应室中通常使用常压,在此条件下SO2的转化率为90%。但是部分发达国家采取高压条件下制取SO3,采取加压措施的目的除了加快反应速率外,还可以____________________________,从而提高生产效率。
(4)工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染,废物利用的目的。用化学方程式表示其反应原理:____________________________________________________
________________________________________________________________________
________________________________________________________________________。
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是________。
A.海水提溴:海水浓缩
 溴蒸气
溴蒸气

 液溴
液溴
B.海水提镁:海滩贝壳
 石灰水
石灰水

 MgO
MgO 镁
镁
C.工业制硝酸:空气 NO2
NO2 硝酸—→尾气处理
硝酸—→尾气处理
D.工业合成氨:天然气 氢气
氢气 NH3、H2、N2
NH3、H2、N2 氨
氨
查看答案和解析>>
科目:高中化学 来源: 题型:
现有几组物质的熔点( ℃)数据:
| A组 | B组 | C组 | D组 |
| 金刚石:3 550 ℃ | Li:181 ℃ | HF:-83 ℃ | NaCl:801 ℃ |
| 硅晶体:1 410 ℃ | Na:98 ℃ | HCl:-115 ℃ | KCl:776 ℃ |
| 硼晶体:2 300 ℃ | K:64 ℃ | HBr:-89 ℃ | RbCl:718 ℃ |
| 二氧化硅:1 723 ℃ | Rb:39 ℃ | HI:-51 ℃ | CsCl:645 ℃ |
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是____________________。
(2)B组晶体共同的物理性质是________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_________________。
(4)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为 。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为 。
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示) 。
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是
。
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似金刚石,甚至硬度超过金刚石,其原因是
。
(6)如图为石墨晶胞结构示意图,该晶胞中含有C原子的个数为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式:_____________________,
其中含有的化学键是______________,属于晶体类型为________。
(2)用电子式表示Y2O的形成过程______________________。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是________(填化学式)。
(4)XH3、H2Z和HW三种化合物,其空间构型分别为________、________、________。其中一种与另外两种都能反应的是______________(填化学式),其生成物晶体类型分别属于________、________。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在273 K和101 kPa的条件下,将2.00 g氦气、1.40 g氮气和1.60 g氧气混合,该混合气体的体积是
A.6.72 L B.7.84 L C.10.08 L D.13.44 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com