
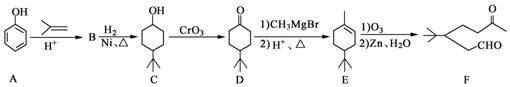
 .
. ,A到B的反应类型为加成反应.
,A到B的反应类型为加成反应. (任写一种).
(任写一种).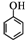 )和CH2=CH2为原料制备有机物 的
)和CH2=CH2为原料制备有机物 的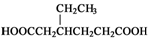 合成路线流程图(无机试剂任用).
合成路线流程图(无机试剂任用).分析 根据题中各物质的转化关系可知,由A 到C
到C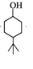 的变化分别是:在苯酚的对位上发生加成反应引入了一个烷烃基(丁基),然后苯环上发生与氢气的加成,变为环己烷,据此可以推断出B的结构简式为:
的变化分别是:在苯酚的对位上发生加成反应引入了一个烷烃基(丁基),然后苯环上发生与氢气的加成,变为环己烷,据此可以推断出B的结构简式为: ,然后C中醇羟基被氧化生成酮基,即得到D,E发生氧化反应生成F.
,然后C中醇羟基被氧化生成酮基,即得到D,E发生氧化反应生成F.
(5)苯酚和乙烯发生加成反应生成对羟基乙苯,对羟基乙苯发生加成反应生成4-乙基环己醇,4-乙基环己醇发生消去反应生成3-乙基环己烯,3-乙基环己烯发生氧化反应生成OHCCH2CH(CH2CH3)CH2CH2CHO,OHCCH2CH(CH2CH3)CH2CH2CHO发生氧化反应生成 .
.
解答 解:根据题中各物质的转化关系可知,由A 到C
到C 的变化分别是:在苯酚的对位上发生加成反应引入了一个烷烃基(丁基),然后苯环上发生与氢气的加成,变为环己烷,据此可以推断出B的结构简式为:
的变化分别是:在苯酚的对位上发生加成反应引入了一个烷烃基(丁基),然后苯环上发生与氢气的加成,变为环己烷,据此可以推断出B的结构简式为: ,然后C中醇羟基被氧化生成酮基,即得到D,E发生氧化反应生成F.
,然后C中醇羟基被氧化生成酮基,即得到D,E发生氧化反应生成F.
(1)F中官能团为羰基和醛基,故答案为:羰基、醛基;
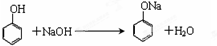
(2)苯酚能和碱反应生成盐和水而证明苯酚具有酸性,如和NaOH溶液反应生成可溶性的苯酚钠,反应方程式为 ,
,
故答案为: ;
;
(3)通过以上分析知,B结构简式为 ,A发生加成反应生成B,
,A发生加成反应生成B,
故答案为: ;加成反应;
;加成反应;
(4)D的分子式为:C10H18O,某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢,故此有机物满足对称结构即可,可以为: 等,
等,
故答案为: ;
;
(5)要以苯酚(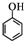 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物 ,可以先用苯酚与乙烯加成反应生成对乙基苯酚,对乙基苯酚加成生成对乙基环己醇,对乙基环己醇消去生成3-乙基环己烯,3-乙基环己烯氧化生成产物,故流程为:
,可以先用苯酚与乙烯加成反应生成对乙基苯酚,对乙基苯酚加成生成对乙基环己醇,对乙基环己醇消去生成3-乙基环己烯,3-乙基环己烯氧化生成产物,故流程为: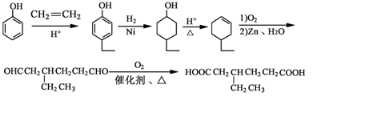 ,
,
故答案为: .
.
点评 本题考查有机合成,为高频考点,根据反应前后结构简式变化确定反应类型,侧重考查学生分析判断及合成路线设计能力,需要学生熟练掌握常见有机反应类型、反应条件,难点是(5)题路线设计.


科目:高中化学 来源: 题型:选择题
| A. | 室温下,1L pH=13的氢氧化钡溶液所含OH- 数为0.2NA | |
| B. | 标准状况下,0.1molAl3+含有的核外电子数为0.3 NA | |
| C. | 常温下,44gCO2中含有2NA个碳氧双键 | |
| D. | 将1 molN2 和3mol H2 通入密闭容器中,一定条件下充分反应,转移电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2和盐酸; Cu(OH)2和CH3COOH | |
| B. | BaCl2和Na2SO4; Ba(OH)2和CuSO4 | |
| C. | NaHCO3和NaHSO4 Na2CO3和NaHSO4 | |
| D. | NaHCO3( 过量)和Ca(OH)2 Ca(HCO3)2 和NaOH( 过量) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 醋酸钠中加入盐酸:CH3COONa+H+→CH3COOH+Na+ | |
| B. | 在硫酸作催化剂、加热条件下乙烯与水发生加成反应:CH2═CH2+H2O $→_{△}^{H_{2}SO_{4}}$ CH3CH2OH | |
| C. | 甲醛溶液中加入足量的银氨溶液并加热: HCHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| D. | 2分子甘氨酸 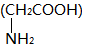 在一定条件下脱去2分子水: 在一定条件下脱去2分子水: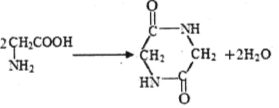 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
把80mL氢氧化钠 溶液加入到120mL盐酸中,所得溶液的pH为2。如果混合前氢氧化钠溶液和盐酸的物质的量浓度相同,它们的浓度是 ( )
溶液加入到120mL盐酸中,所得溶液的pH为2。如果混合前氢氧化钠溶液和盐酸的物质的量浓度相同,它们的浓度是 ( )
A.0.5mol/L B.0.1mol/L C.0.05mol/L D.1mol/L
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:填空题
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:

已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围 ,检验Fe3+已经除尽的操作是 ;
②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度小于或等于1×10-5 mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥ 。[已知:Ksp[Cr(OH)3] = 6.3×10-31, ≈4.0]。
≈4.0]。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | x | 465 | 413 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com