
| A、①②③④⑤ | B、②④ | C、①②③⑤ | D、②③④ |


科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
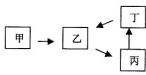 甲、乙、丙、丁四种物质有如图所示的转化关系,已知甲是地壳中含量最高的元素组成的单质,常见化合物乙、丙、丁均含有短周期一种相同元素(除组成甲的元素外).
甲、乙、丙、丁四种物质有如图所示的转化关系,已知甲是地壳中含量最高的元素组成的单质,常见化合物乙、丙、丁均含有短周期一种相同元素(除组成甲的元素外).查看答案和解析>>
科目:高中化学 来源:101网校同步练习 高一化学 山东科学技术出版社 鲁教版 题型:021
|
将过量的二氧化碳分别通入①CaCl2溶液;②Na2SiO3溶液;③Ca(ClO)2溶液;④饱和Na2CO3溶液.最终溶液中有白色沉淀析出的是 | |
A. |
①②③④ |
B. |
②④ |
C. |
①②③ |
D. |
②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com