
| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. | 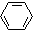 +HNO3$→_{60℃}^{浓硫酸}$ +HNO3$→_{60℃}^{浓硫酸}$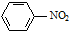 +H2O +H2O | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$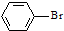 +HBr +HBr |
分析 取代反应:有机物分子里的原子或原子团被其他原子或原子团代替的反应;
加成反应:有机物分子中的双键或叁键发生断裂,加进(结合)其它原子或原子团的反应叫加成反应.
解答 解:A.乙酸和乙醇生成乙酸乙酯的反应是酯化反应,酯化反应也是取代反应,故A错误;
B.乙炔与氯化氢反应,乙炔中的碳碳三键断裂,每个碳原子上分别结合一个氢原子生成乙烯,属于加成反应,故B正确;
C. +HNO3$→_{60℃}^{浓硫酸}$
+HNO3$→_{60℃}^{浓硫酸}$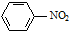 +H2O,苯环上的氢原子被硝基取代,该反应属于取代反应,故C错误;
+H2O,苯环上的氢原子被硝基取代,该反应属于取代反应,故C错误;
D. +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,苯环上的氢原子被溴原子取代,该反应属于取代反应,故D错误;
+HBr,苯环上的氢原子被溴原子取代,该反应属于取代反应,故D错误;
故选B.
点评 本题考查有机物的性质,注意取代反应与其它反应类型的区别,题目较为简单.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=l的溶液中:Ca2+、Fe2+、NO3- | |
| B. | $\frac{Kw}{c(O{H}^{-})}$=10-2的溶液中:Na+、NH4+、Cl- | |
| C. | c(Fe3+)=0.1 mol.L-1的溶液中:K+、SCN-、SO42- | |
| D. | 由水电离的c(H+)=1×10-14 mol.L-1的溶液中:Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
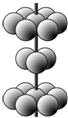 X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn.
X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn.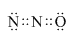 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KF的电子式: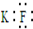 | |
| B. | 异丁烷的结构简式:CH3CH2CH2CH3 | |
| C. | 硫离子的结构示意图: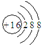 | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaCl、NaBr、NaI混合溶液中通入F2:I-、Br-、Cl- | |
| B. | 向NaCl、NaI、Na2S混合溶液中滴加AgNO3溶液:S2-、I-、Cl- | |
| C. | 向FeCl3、CuCl2、HCl混合溶液中加入Zn粉:Cu2+、Fe3+、H+ | |
| D. | 向NaAlO2、Na2CO2、NaOH混合溶液中滴加稀盐酸:AlO2-、CO32-、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4(熔融)═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | CH3COOH?CH3COO-+H+ | D. | H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com