
下列各原子或离子的电子排布式错误的是( )
A.C 1s22s22p2
B.O2- 1s22s22p6
C.Cr 1s22s22p63s23p63d44s2
D.Al3+ 1s22s22p6
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA( )
(2)标准状况下,22.4 L NO2气体中所含分子数目为NA( )
(3)100 g 17%的氨水,溶液中含有的NH3分子数为NA( )
(4)标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA( )
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
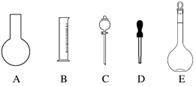
(1)如图所示的仪器中配制溶液肯定不需要的是________________________________________________________________________
(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“>”、“<”或“=”)0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
当基态原子的第四电子层只有2个电子,则原子的第三电子层的电子数为( )
A.肯定为8个电子 B.肯定为18个电子
C.肯定为8~18个电子 D.肯定为8~32个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电子排布式中,原子处于激发态的是( )
A.1s22s22p5
B.1s22s22p43s2
C.1s22s22p63s23p63d54s1
D.1s22s22p63s23p63d34s2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.范德华力是普遍存在的一种分子间作用力,属于电性作用
B.范德华力比较弱,但范德华力越强,物质的熔点和沸点越高
C.氢键属于一种较强的分子间作用力,只能存在于分子间
D.形成氢键时必须含有氢原子,另外氢原子两边的原子必须具有很强的电负性、很小的原子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
非晶体指内部微粒排列呈现杂乱无章的分布状态的固体。下列关于非晶体的叙述中,错误的是( )
A.是物质的一种聚集状态 B.内部微粒的排列是长程无序和短程有序的
C.非晶体材料的所有性能都优于晶体材料 D.金属形成的合金也有非晶体的
查看答案和解析>>
科目:高中化学 来源: 题型:
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是____________________________ 。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO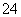 、Br-、HCO
、Br-、HCO 等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:

①向曝气池中通入空气的目的是______________________________________________。
②通入空气后,曝气池中的海水与天然海水相比,浓度有明显不同的离子是______(填字母)。
a.Cl- b.SO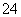 c.Br- d.HCO
c.Br- d.HCO
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)

①图中a极连接电源的______(填“正”或“负”)极,C口流出的物质是________。
②SO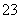 放电的电极反应为________________________。
放电的电极反应为________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释碱性增强的原因:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com