
����Ŀ������0.1000 mol��L��1KMnO4������Һ�ζ�δ֪Ũ�ȵ���ɫH2C2O4��Һ����Ӧ���ӷ���ʽ�ǣ�2MnO4����5H2C2O4��6H+ = 2Mn2+��10CO2����8H2O
���������⣺
��1���õζ�ʵ������IJ���������______________��������ĸ��
A����ʽ�ζ���B����ʽ�ζ��� C����Ͳ D����ƿ E������̨F���ζ��ܼ�G���ձ�H����ֽ I��©��
��2������________(��ᡱ�)ʽ�ζ���ʢ�Ÿ��������Һ���Է���ԭ��___________________________________________��
��3���ζ��յ������Ϊ___________________________________��
��4�����ζ���ʼ�ͽ���ʱ���ζ����е�Һ����ͼ��ʾ������ʼ����Ϊ________mL���յ����Ϊ________mL��
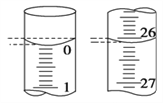
��5��ijѧ������3��ʵ��ֱ��¼�й��������±���
�ζ� ���� | ����H2C2O4��Һ�����/mL | 0.1000 mol/L KMnO4�������mL�� | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 26.11 | 26.11 |
�ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
������ | 25.00 | 0.22 | 26.31 | 26.09 |
�����ϱ�������ʽ�����H2C2O4��Һ�����ʵ���Ũ��Ϊ_______________��
��6�����в����п���ʹ�ⶨ���ƫ�͵���___________(����ĸ)��
A����ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע��KMnO4��Һ
B���ζ�ǰʢ�Ų�����Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ���������
D����ȡKMnO4��Һʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
���𰸡� ADG �� ������ؾ���ǿ�������ܸ�ʴ�ܣ�����������Һ�ܰ��������� �������һ�θ��������Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ��ָ�ԭɫ 0.00 26.10 0.2610 mol/L CD
����������1����������ԭ�ζ����貣�������У�ʢװ����KMnO4��Һ��ȡ�ô���ҺH2C2O4��Һ����ʽ�ζ��ܡ�ʢװ����ҺH2C2O4��Һ����ƿ������Һ�漰������ʱʢ����Һ�õ��ձ�������ӦѡADG��
��2����Ϊ������ؾ���ǿ�������ܸ�ʴ�ܣ����Բ��ü�ʽ�ζ���ʢ�Ÿ��������Һ��
��3��MnO4-Ϊ��ɫ��K+Ϊ��ɫ�����������һ�θ��������Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ��ָ�ԭɫ����˵���ﵽ�ζ��յ㡣
��4����ͼ��ʾ������ʱ����Ӧ�밼Һ����ʹ����У�����ʼ����Ϊ0.00mL���յ����Ϊ26.10mL��
��5����2������������������ϴ������ݵ���Ч�ԣ�Ӧ��ȥ��2�����ݣ����ĵ�V(KMnO4)=(26.11+26.09)mL��2=26.10mL���ɷ���ʽ2MnO4����5H2C2O4��6H+ = 2Mn2+��10CO2����8H2O�ɵ���n(H2C2O4)= ![]() n(MnO4-)������c(H2C2O4)��0.025L=
n(MnO4-)������c(H2C2O4)��0.025L=![]() ��0.1000molL-1��0.02610L�����c(H2C2O4)=0.2610molL-1��
��0.1000molL-1��0.02610L�����c(H2C2O4)=0.2610molL-1��
��6������c(��)= 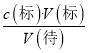 ������������A���ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע��KMnO4��Һ�����Һ��Ũ��ƫС�����V(��)ƫ��c(��)ƫ��A����B��ζ�ǰʢ��H2C2O4��Һ����ƿ������ˮϴ����û�и����V(��)û��Ӱ�죬c(��)���䣬��B����C���ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ��������ݣ����V(��)ƫС��c(��)ƫС����C��ȷ��D���ȡKMnO4��Һʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ��������V(��)ƫС��c(��)ƫС����D��ȷ��
������������A���ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע��KMnO4��Һ�����Һ��Ũ��ƫС�����V(��)ƫ��c(��)ƫ��A����B��ζ�ǰʢ��H2C2O4��Һ����ƿ������ˮϴ����û�и����V(��)û��Ӱ�죬c(��)���䣬��B����C���ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ��������ݣ����V(��)ƫС��c(��)ƫС����C��ȷ��D���ȡKMnO4��Һʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ��������V(��)ƫС��c(��)ƫС����D��ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������ͨ��ˮ�У�������ѧ��Ӧ�ķ���ʽ��_______�������йط�������ȷ����_______��
A������ʱ����������ˮ
B��ͨ������°�����ˮ�е��ܽ�Ȳ���
C������ˮ�İ���������������������
D����ˮ�е�NH3H2O�ɵ��������OH��
E������������������
F���ڱ��Ͱ�ˮ�к�������������NH3H2O
��2����ˮ��������;������дһ���ð�ˮ��ȡ�����Լ�ķ���ʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ͼ��������ȷ����

A. ������H1=-(��H2+��H3)
B. �ұ�ʾ���º��������·����Ŀ��淴Ӧ2NO2(g)![]() N2O4(g)�У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
N2O4(g)�У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
C. ����ʾA��B�����ʵ��ܽ�����¶ȱ仯�������t1��ʱA��B�ı�����Һ�ֱ�������t2��ʱ,���ʵ���������B>A
D. ����ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����NaA��Һ��pH���ڵ����ʵ���Ũ�ȵ�NaB��Һ��pH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������(����)
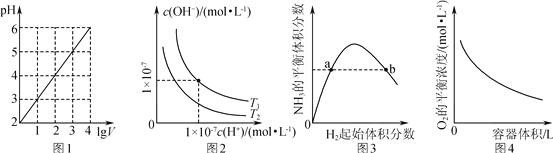
A. ͼ1��ʾ1 L pH��2��CH3COOH��Һ��ˮϡ����V L��pH��lg V�ı仯
B. ͼ2��ʾ��ͬ�¶���ˮ��Һ��H����OH��Ũ�ȵı仯�����ߣ�ͼ���¶�T2>T1
C. ͼ3��ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ�������(N2����ʼ���㶨)�ı仯��ͼ��a��N2��ת����С��b��
D. ͼ4��ʾͬһ�¶��£��ڲ�ͬ�ݻ��������н��з�Ӧ2BaO2(s) ![]() 2BaO(s)��O2(g)��O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
2BaO(s)��O2(g)��O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp[Fe(OH)3]=2.6��10-39���ش�����������
��1��FeCl3��Һ��������ˮ�����侻ˮԭ��Ϊ�������ӷ���ʽ��ʾ����______________________��
��2��ij����MgCl2��Һ�к�������FeCl3��Ϊ�õ�������MgCl2��Һ���ɼ���___________������Һ��pH=4��ʹ��Һ�е�Fe3+��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3+)=_________________��
��3����FeCl3��6H2O����õ�������ˮFeCl3�ĺ�����������______________________________��
��4�������������Ʊ��ߴ��Ȼ������۵�ԭ�ϣ�����Ʒ���Ȳⶨ����������ȷ��ȡ����������FeC2O4����Ʒwg�������гɷ�ĩ������������ϡ���������������ʲ���Ӧ�����250omL��Һ��ȷ��ȡ20mL����Һ����ƿ�У���cmol/L��K2Cr2O7������Һ����ϡ�����ữ���ζ����յ㣬���ĵζ�ҺVmL����ԭ����ΪCr3+����������ΪFe3+��CO2����
�ٵζ�ʱ��Ӧ�����ӷ���ʽΪ____________________________________��
�ڸò���������Ʒ�Ĵ���Ϊ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽�� Fe3���� Cu2���� H2O2 �ֽⷴӦ�Ĵ�Ч�����ס�������ͬѧ�ֱ��������ͼ1��ͼ 2��ʾ��ʵ�顣���������в���ȷ���ǣ� ��
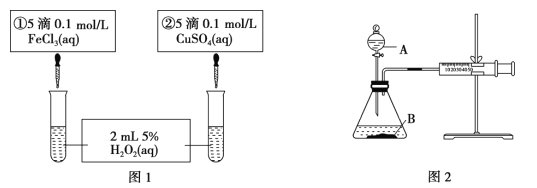
A. ͼ 1 ʵ���ͨ���۲�������ݵĿ������ȽϷ�Ӧ���ʵĴ�С
B. ��ͼ 1 ��ʾʵ������Ϊ��>�ڣ���һ����˵�� Fe3���� Cu2���� H2O2 �ֽ��Ч����
C. ��ͼ 2 װ�ñȽϷ�Ӧ���ʣ��ɲⶨ��ͬʱ����ͬ״��������������Ķ��ٽ��бȽ�
D. ͼ 2 �н�ע������������һ�����룬һ��ʱ����ɿ��������ܷ���ԭ������©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ�����ͼ��ʾ����������������ǣ�

A. ������ˮ�ķ�����Ҫ�������������������ӽ�����
B. ��NaClΪԭ�Ͽ��������ռ��������ơ�����������Ȼ�����Ʒ
C. ������й����ȿ��������壬����Ϊ���������ܶȱȿ������ܶ�С
D. ��SO2ˮ��Һ����Br2�����ӷ�Ӧ����ʽΪ��Br2+SO2+2H2O�T4H++SO42��+2Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����
�� �ȣ��棩 | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�ӦΪ_____ ������ȣ����ȣ���ȷ��������Ӧ��
�����д�ʩ������������ԭ��������_____������ţ���
a������ѹǿ�����ںϳɰ� b��ʹ�ú��ʵĴ��������ڿ������ɰ�
c����������Ҫ�����¶���500��C���� d����Ҫʹ�ù�����N2�����H2ת����
��2��0.2mol��������ˮ�����뺬��0.2mol�������Һ��Ӧ����QkJ���������Ȼ�ѧ����ʽ��ʾ�䷴Ӧʽ_____��
��3������ʱ����amol��������ˮ����ͨ��bmol�Ȼ��⣬��Һ���Ϊ1L����c��NH4+��=c��Cl��������һˮ�ϰ��ĵ���ƽ�ⳣ��Kb=_____����ab��ʾ����
��4��ԭ����H2��ͨ����Ӧ CH4��g��+H2O ��g��![]() CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��

��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1_____P2�����������=����������
����������һ���������¶ȣ������IJ��ʻ�__�����������С����С�������䡱���䣩��
��5��ԭ����H2����ͨ����ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ȡ��
CO2��g��+H2��g����ȡ��
��T��ʱ�����ݻ��̶�Ϊ5L�������г���1molˮ������1mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0.08molL��1�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_____��
�ڱ����¶���ΪT�����ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������[Ce(OH)4]��һ����Ҫ��ϡ��������Է�̼���(��Ҫ��CeFCO3)Ϊԭ���Ʊ�Ce(OH)4��һ�ֹ����������£�
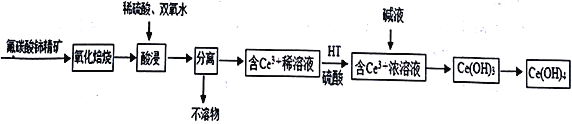
��֪����������Һ��Ce4+��ǿ�����ԡ��ش�����������
��1�� ������������ǰ�轫��ʯ�����ϸ��������Ŀ����_________________________��������CeFCO3 ��Ce �Ļ��ϼ�Ϊ________________________��
��2�������������ɵ��滯����Ϊ��������(CeO2)���������ʱ������Ӧ�����ӷ���ʽΪ__________________________________�����ʱ�����¶ȹ��ߵ�ԭ����____________________��
��3����֪�л���HT �ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��2 Ce3+ (ˮ��) +6HT (�л���)![]() 2CeT3 (�л���) +6H+ (ˮ��)
2CeT3 (�л���) +6H+ (ˮ��)
��ƽ���ƶ��ǶȽ����� ��CeT3(�л���) ����H2SO4��ýϴ��ĺ�Ce3+��ˮ��Һ��ԭ����____________________��
��4��Ce(OH)3��¶�ڿ�����ʱ�����ɫ�����ձ�ɻ�ɫ��Ce(OH)4���÷�Ӧ�Ļ�ѧ����ʽΪ________________________________��
��5����֪298 K ʱ��Ksp[Ce(OH)3]=1��10-20��Ϊ��ʹ��Һ��Ce3+������ȫ�������pHΪ______���ϡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com