
已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4 气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气燃烧的热化学方程式 。
(2)若1 molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为  890 kJ(填“>”、 “<”、“= ”)。
890 kJ(填“>”、 “<”、“= ”)。
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水时, 则放出热量(Q)的取值范围是 __________________________ 。
则放出热量(Q)的取值范围是 __________________________ 。
(4)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的的取值范围是____________________________________。
科目:高中化学 来源: 题型:
| 4 |
| 3Vt |
| 4 |
| 3Vt |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 13 |
| 2 |
| 13 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
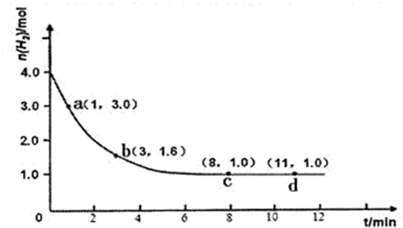
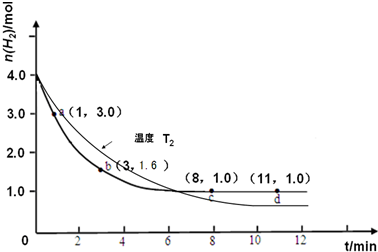

| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1) 合成氨工业中原料气压缩到30~50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(2) 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K1,此时N2的转化率为x。则K1和x的关系满足K1= 。若温度为400℃,平衡常数为K2,则K1 K2(填“<”、“=”或“>” )
(3) 甲烷在高温下与水蒸气反应的热化学反应方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g); △H kJ·mol-1。
又已知:H2(g) +1/2 O2(g)== H2O(l); △H1=-285.8kJ/mol
CO(g) + 1/2 O2(g)=CO2(g);△H2=-283.0kJ/mol
CH4(g) +2 O2(g)== CO2(g)+ 2H2O(l); △H3=-890.3kJ/mol
H2O(g) == H2O(l); △H4=-44.0kJ/mol
①写出H2(g)完全燃烧生成气态水的热化学方程式 。
② CH4(g)+H2O(g)=CO(g)+3H2(g); △H= kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com