
【题目】在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g)CO(g)+H2O(g),其平衡常数K和温度t的关系如下:
T/℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为: .
(2)该反应的正反应为 反应(“吸热”或“放热”).
(3)能判断该反应是否已经达到化学平衡状态的是 .
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=C(CO)
【答案】(1)![]() ;(2)放热;(3)B、C;
;(2)放热;(3)B、C;
【解析】
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据方程式可知该反应的平衡常数表达式K=![]() ;
;
(2)根据表中数据可知升高温度平衡常数K减小,说明反应向逆反应方向进行,因此正反应是放热反应。
(3)A.反应前后体积不变,则容器中压强始终不变,不能说明反应达到平衡状态,A错误;B.混合气体中CO浓度不变,说明反应达到平衡状态,B正确;C.v正(H2)=v逆(H2O)表示正逆反应速率,且满足反应速率之比是相应化学计量数之比,因此反应达到平衡状态,C正确;D.c(CO2)=c(CO)不能说明正逆反应速率是否相等,因此不一定达到平衡状态,D错误,答案选BC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
B | 物质的量之比为2:3的稀硝酸和稀硫酸
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸制取乙烯,其反应式为CH3CH2OH![]() CH2=CH2↑+H2O实验时常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
CH2=CH2↑+H2O实验时常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
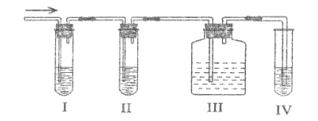
I、II、III、IV装置可以盛放的试剂有:
A、品红溶液 B、NaOH溶液
C、浓硫酸 D、酸性KMnO4溶液(试剂可以重复使用)
(1)I、II、III、IV装置中所盛的试剂分别为:_________、_________、_________、_________(填序号)
(2)使用装置II的目的是_________________。
(3)确定含有乙烯的现象是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与化学键有关的是( )
A.H2O在高温下也难分解
B.F2、Cl2、Br2、I2单质的熔点依次升高
C.SiH4的熔点高于CH4的熔点
D.NH3的沸点高于PH3的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
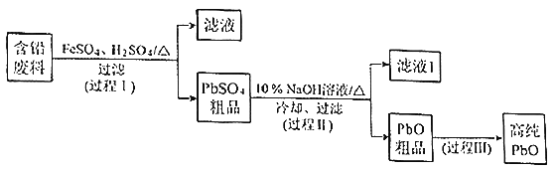
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。
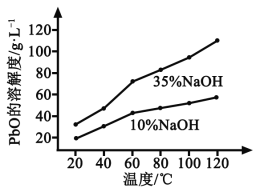
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是____._(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将23 g Na、18 g Al、56 g Fe分别投入盛有200 g 7.3%的盐酸中,结果正确的是( )
A. 反应结束时产生的气体一样多
B. Al和盐酸的反应速率仅次于钠,但产生的气体最多
C. 铁和盐酸反应产生的气体比Na产生的多
D. Na和盐酸反应最剧烈,产生的气体最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
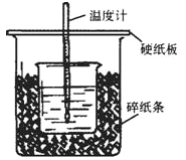
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________________
(2)在测定中和热的实验中,计算反应热时需要的数据有________________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容
④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_______ (填“相等”或“不相等”),所放出的热量____ (填“相等”或“不相等”)
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会_____(填“偏大”、“偏小”或“无影响”).
Ⅱ.甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。已知:①下图为反应的能量变化和物质键能
CH3OH(g)。已知:①下图为反应的能量变化和物质键能
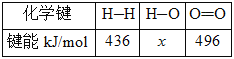
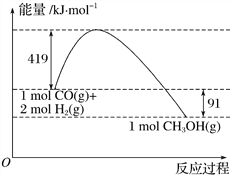
②CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。回答下列问题:
(1)Z元素在周期表中的位置为_________。
(2)表中元素原子半径最大的是(填元索符号)_________。
碳 | 氮 | Y | |
X | 硫 | Z |
(3)下列亊实能说明Y元素的非金属性比S元素的非金属性强的__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,lmolY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成lmolX的最高价化合物,恢复至室温,放热687kJ,己知该化合,物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:________________。
(5)碳与镁形成的lmol化合物Q与水反应,生成2molMg(OH)2和lmol烃,该烃分子中碳氢质量比为9:1,烃的电子式为_______,Q与水反应的化学方程式为 _________________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗lL2.2mol/LNaOH溶液和1molO2,則两种气体的分子式及物质的量分别为_____________,生成硫酸铜物质的量为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com