
| A. | 苯酚、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、甲酸钠溶液、乙酸乙酯 | D. | 苯乙烯、苯酚、乙苯、甲苯 |
分析 A.可用溴水鉴别;
B.乙烯、乙炔、丙烯都含不饱和键,用一种试剂不能鉴别;
C.用一种试剂不能鉴别甲酸、乙醛、甲酸钠溶液;
D.用一种试剂不能鉴别乙苯和甲苯.
解答 解;A.可加入溴水鉴别,加入溴水,苯酚生成白色沉淀,乙醇和水混溶,苯不溶于水,且密度不水小,四氯化碳不溶于水,密度比水大,可鉴别,故A正确;
B.乙烯、乙炔、丙烯都含不饱和键,用一种试剂不能鉴别,故B错误;
C.甲酸、乙醛和甲酸钠都含有醛基,则不能用一种酯基鉴别,故C错误;
D.乙苯和甲苯都可与酸性高锰酸钾发生氧化还原反应,与溴水不反应,不能鉴别,故D错误.
故选A.
点评 本题考查有机物的鉴别,为考试高频考点,侧重于学生的分析能力和综合运用化学知识的能力的考查,难度不大,注意把握物质的性质的异同.


科目:高中化学 来源: 题型:填空题
 .
.| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ Na+ OH- | B. | Na+ H+ SO32- | ||
| C. | K+ NO3- Cl- | D. | Ca2+ NO3- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
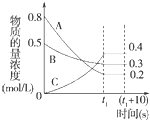 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题: 2C.
2C.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .从分液漏斗上口倒出的上层液体是苯.
.从分液漏斗上口倒出的上层液体是苯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
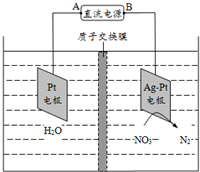
| A. | 电源的正极为b | |
| B. | 电解时H+从膜右侧迁移到膜左侧 | |
| C. | Ag-Pt电极反应为:2H2O-4e-=4H++O2↑ | |
| D. | 若转移的电子数为1.204×1024,生成N25.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质失电子的反应为氧化反应 | |
| B. | 物质在变化中失去了电子,此物质是氧化剂 | |
| C. | 发生电子转移的反应即是氧化还原反应 | |
| D. | 发生化合价升降的反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
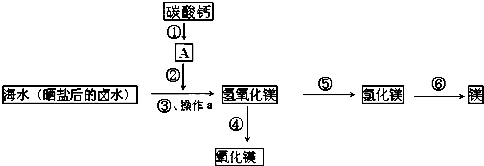
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com