
| A. | 16:9 | B. | 23:9 | C. | 1:2 | D. | 2:1 |
分析 首先根据化学方程式和已知条件“R和M的相对分子质量之比为22:9”以及R的质量,列出比例式,即可求出M的质量;
然后根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,则Y的质量=R的质量+M的质量-X的质量;然后写出两者的比,据此选择即可.
解答 解:根据已知条件“R和M的相对分子质量之比为22:9”,则R:2M=22:2×9=22:18,
设生成的M的质量为a,则22:18=4.4g:a,解之得:a=3.6g;
再根据质量守恒定律可得Y的质量=4.4g+3.6g-1.6g=6.4g;
所以此反应中Y和M的质量比是6.4g:3.6g=16:9,
故选:A.
点评 本题主要考查学生运用化学方程式和质量守恒定律解答实际问题的能力.


科目:高中化学 来源: 题型:实验题
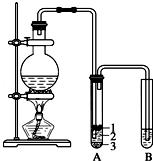 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg-Al | HNO3(浓) | Mg→Al |
| ② | Mg-Al | HCl(aq) | Mg→Al |
| ③ | Mg-Al | NaOH(aq) | Al→Mg |
| ④ | Al-Cu | HNO3(浓) | Cu→Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Al3+、NH4+、Cl-、HCO3- | |
| B. | 使紫色石蕊试纸变红色的溶液:Cl-、NO3-、Fe2+、K+ | |
| C. | 常温下,pH=13的溶液:K+、CO32-、Na+ | |
| D. | c(H+)=0.1mol/L的溶液:CO32-、Na+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液一定是等体积混合 | B. | 溶液中:c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+) | ||
| C. | 溶液中2c(R2-)+c(HR-)=c(Na+) | D. | 溶液中:c(HR-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95g | B. | 10g | C. | 50g | D. | 100g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
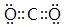 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程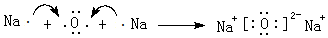 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定溶液的pH值,应先将pH试纸用蒸馏水润湿 | |
| B. | 称量加热后的固体时,均需先将固体在空气中冷却后再称量 | |
| C. | 配制0.1mol/LNa2CO3溶液时,容量瓶应先用0.1mol/L Na2CO3润洗 | |
| D. | 除去铁粉中混有的少量铝粉,可加人过量的氢氧化钠溶液,完全反应后过滤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

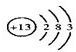 ; F的化学式FeCl2.
; F的化学式FeCl2.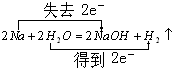 .反应②:
.反应②: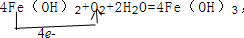 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com