
| A. | 蓝色硫酸铜 | B. | 液体浓硫酸 | C. | 无水氯化钙 | D. | 白色碱石灰 |
科目:高中化学 来源: 题型:解答题
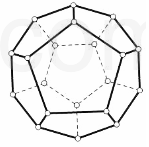 2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.
2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
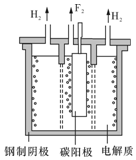 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝可作胃酸的中和剂 | B. | 工业上采用电解熔融氯化铝制铝 | ||
| C. | 铝罐可久盛食醋 | D. | 明矾用作净水剂不涉及化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
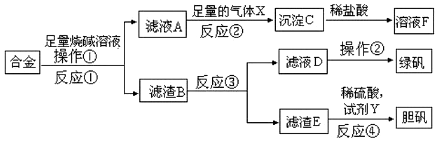
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48L Cl2溶于水所得氯水中含氯的微粒总数为0.4NA | |
| B. | 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4NA | |
| C. | 常温下,pH=2的盐酸溶液中含有的H+数目为0.02NA | |
| D. | 常温下,1L 0.5mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
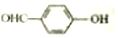
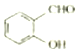 <
<
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l) | B. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l) | ||
| C. | 2H2(g)+O2(g)═2H2O(l) | D. | 2FeCl3(aq)+Fe(s)═3FeCl3(aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com