
| A. | 2Fe2(SO4)3•(NH4)2SO4•2H2O | B. | Fe2(SO4)3•2(NH4)2SO4•2H2O | ||
| C. | Fe2(SO4)3•2(NH4)2SO4•6H2O | D. | 2Fe2(SO4)3•(NH4)2SO4•6H2O |
分析 称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到沉淀并烘干灼烧至恒重得到1.60g固体为氧化铁,n(Fe2O3)$\frac{1.6g}{160g/mol}$=0.01mol,生成氢氧化铁沉淀物质的量为,n(Fe(OH)3)=0.02mol,
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol,
求n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)的之比,从而分析得出化学式.
解答 解:称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到沉淀并烘干灼烧至恒重得到1.60g固体为氧化铁,n(Fe2O3)$\frac{1.6g}{160g/mol}$=0.01mol,生成氢氧化铁沉淀物质的量为,n(Fe(OH)3)=0.02mol,
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol,
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O,
故选B.
点评 本题考查了元素及化合物知识反应等相关知识,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意守恒方法的应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 CuO可用作颜料、玻璃磨光剂、有机合成催化剂等.以下是用铜粉氧化法生产CuO的流程图:
CuO可用作颜料、玻璃磨光剂、有机合成催化剂等.以下是用铜粉氧化法生产CuO的流程图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ?
?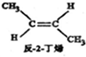 ,△H=-4.2kJ.mol-1
,△H=-4.2kJ.mol-1 (g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
(g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、H+、C1- | B. | Na+、Ba2+、Mg2+、NO3- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | K+、Na+、CO32-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的Ba(OH)2溶液滴加到NaHCO3溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| B. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不溶于水,且必须易与碘发生化学反应 | |
| B. | 不溶于水,不与碘发生化学反应且比水更易溶解碘 | |
| C. | 不溶于水,且必须比水密度大 | |
| D. | 不溶于水,且必须比水密度小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑤ | C. | ③④⑤ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com