
【题目】pH相等的盐酸和醋酸各100mL,分别与过量的Zn反应,相同条件下生成H2的体积V(盐酸)V(醋酸)(填>;=;<)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+,NH4+,Ba2+,Mg2+,Ag+,OH﹣,SO42﹣,CO32﹣中的某几种,现用该溶液做以下实验:①取此溶液少许,加入足量盐酸无明显现象;②另取少许加入足量浓氢氧化钠溶液,有白色沉淀生成;③将②中沉淀过滤,取滤液微热,有无色刺激性气味气体放出,该气体能使湿润的红色石蕊试纸变蓝.
(1)由此推断,该溶液中肯定有_______________离子,肯定无__________________离子.
(2)写出③反应的化学方程式___________________________________________________.
(3)不能确定是否存在的离子有________________,检验的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程)_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种可快速充放电的超性能铝离子电池,Al、Cn为电极,有机阳离子与阴离子(AlCl![]() 、Al2Cl
、Al2Cl![]() )组成的离子液体为电解质。如图为该电池放电过程示意图。下列说法错误的是( )
)组成的离子液体为电解质。如图为该电池放电过程示意图。下列说法错误的是( )
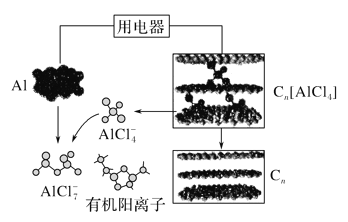
A. 充电时,Al做阴极、Cn为阳极
B. 充电时,每生成1 mol铝,同时消耗4 mol Al2Cl![]()
C. 放电时,电解质中的有机阳离子向铝电极方向移动
D. 放电时,正极反应式为Cn[AlCl4]+ e-=== Cn + AlCl![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药用有机物A为一种无色液体,从A出发可发生如下一系列反应.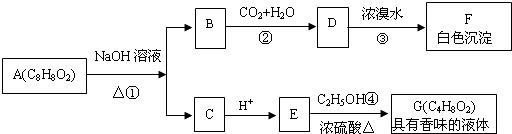
请回答:
(1)E中的官能团名称是 .
(2)A的结构简式为 .
(3)写出反应③的化学方程式: , 该反应的反应类型是 .
(4)写出反应④的化学方程式: .
(5)符合下列条件的A的同分异构体有(不考虑立体异构)种,写出其中一种的结构简式: . ①苯环上有两个取代基; ②能发生水解反应; ③能发生银镜反应.
(6)H是E的一种同分异构体,已知H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应,试写出H发生银镜反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝.电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用.
请回答:
(1)已知:2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJmol﹣1
2C(s)+O2(g)═2CO(g)△H2=﹣221KJmol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是___________________________。
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比).
反应ⅠCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g)![]() CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
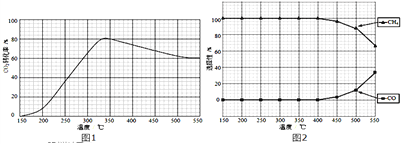
①下列说法不正确的是_______
A.△H4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL该温度下反应Ⅰ的平衡常数为______(用a、V表示)
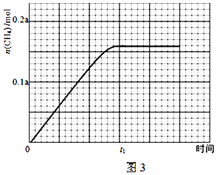
③350℃下CH4物质的量随时间的变化曲线如图3所示.画出400℃下0~t1时刻CH4物质的量随时间的变化曲线_______.
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一学习小组用100g某硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)制备绿矾(FeSO47H2O),主要流程如图: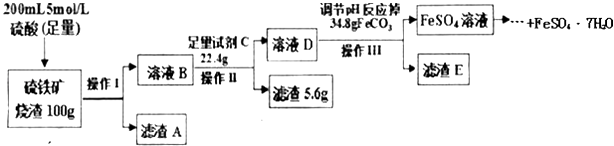
请回答下列问题:
(1)硫铁矿烧渣中加入硫酸酸浸往往需要升温,目的是 , 操作1的名称是 , 滤渣A是 .
(2)试剂C为 , 加入该试剂的目的是(用离子方程式表示).
(3)调节溶液D的pH目的是 .
(4)己知常温下Al(OH)3的Ksp=1.0×10﹣33 , 若溶液中c(Al3+)为1.0mol/L,请计算Al3+开始沉淀的pH= .
(5)依据上述流程中的相关数据,求该硫铁矿烧渣中Fe2O3的质量分数为 . (本实验各操作中损失的硫酸盐、硫酸及调pH后溶液呈微酸性残留的硫酸忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫和亚硫酸钠共热可制备硫代硫酸钠(Na2S2O3),Na2S2O3是重要的化工料,易溶于水,在酸性溶液中发生如下反应:S2O32-+2H+=S↓+SO2↑+H2O。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O),并测定产品的纯度。装置如下(已略去加热装置):
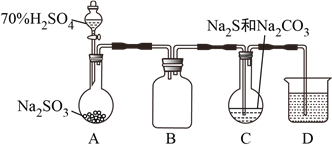
(1)D是尾气处理装置,盛放的溶液可以是__________。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.饱和NaHSO3溶液
(2)C中发生的化学反应有:__________、2Na2S+3SO2=2Na2SO3+3S↓、__________。
(3)经过系列操作,该小组同学从C中制得了Na2S2O3·5H2O,此晶体中可能混有Na2SO3和Na2SO4杂质。接下来,他们做实验证明了则两种杂质的存在,请完成操作:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,__________,沉淀未完全溶解,并有刺激性气味的气体产生(已知Ba2+与S2O32-不生成沉淀)。
(4)该组同学经讨论认为:先向A中滴加70%的H2SO4,产生的气体将装置中的空气排尽后,再向C加入Na2S和Na2CO3混合溶液,可减少装置C中生成的Na2SO4的量,画出改进后的C装置。___________

(5)测定Na2S2O3·5H2O的纯度:称取Wg产品,用适量蒸馏水溶解,滴加少量淀粉溶液,用0.1000mol·L-1碘的标准溶液滴定,反应原理为2S2O32-+I2=S4O62-+2I-。
①判断反应达到滴定至终点的标志是:______________________________。
②滴定起始和终点的液面位置如图,则产品的纯度为(Na2S2O·5H2O的摩尔质量为Mg·mol-1)____________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com