
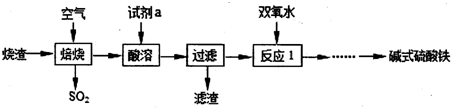
分析 硫酸厂的烧渣的主要成分为铁的氧化物(含少量FeS及SiO2),在空气中焙烧生成二氧化硫气体和固体为SiO2及铁的氧化物,将固体用硫酸溶解生成硫酸亚铁溶液,二氧化硅不溶于酸,为滤渣的成份,滤液中加入双氧水将亚铁离子氧化成铁离子,再调节溶液的pH值可得碱式硫酸铁,
(1)焙烧产生的二氧化硫会形成硫酸型酸雨,根据减小二氧化硫的排放判断减少酸雨的方法;
(2)根据上面的分析可知,酸溶时用硫酸溶解,过滤操作所用的玻璃仪器主要有玻璃棒、烧杯、漏斗;
(3)反应l中加双氧水可以将亚铁离子氧化成铁离子;
(4)为确定碱式硫酸铁的化学式,取碱式硫酸铁样品溶于足量的稀盐酸中并充分混合,加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、干燥、
称重,得硫酸钡沉淀的质量,过滤,在滤液中加入过量的NaOH溶液,充分反应后,再将沉淀过滤、洗涤、灼烧、称重,得氧化铁的质量,根据硫酸钡的质量和氧化铁的质量可计算得硫酸根离子和铁离子的物质的量,根据电荷守恒可计算出氢氧根离子的物质的量,据此确定y:z的值;
解答 解:硫酸厂的烧渣的主要成分为铁的氧化物(含少量FeS及SiO2),在空气中焙烧生成二氧化硫气体和固体为SiO2及铁的氧化物,将固体用硫酸溶解生成硫酸亚铁溶液,二氧化硅不溶于酸,为滤渣的成份,滤液中加入双氧水将亚铁离子氧化成铁离子,再调节溶液的pH值可得碱式硫酸铁,
(1)焙烧产生的二氧化硫会形成硫酸型酸雨,
a.在已酸化的土壤中加石灰,不能防止或减少酸雨产生;
b.对含硫化石燃料进行脱硫处理,可以防止或减少酸雨产生;
c.对产生的二氧化硫进行吸收和利用,可以防止或减少酸雨产生,故选a,
故答案为:硫酸;a;
(2)根据上面的分析可知,酸溶时用硫酸溶解,过滤操作所用的玻璃仪器主要有玻璃棒、烧杯、漏斗,
故答案为:硫酸;漏斗;
(3)反应l中加双氧水可以将亚铁离子氧化成铁离子,使溶液(或滤液)中的Fe2+氧化成Fe3+,
故答案为:使溶液(或滤液)中的Fe2+氧化成Fe3+;
(4)为确定碱式硫酸铁的化学式,取碱式硫酸铁样品溶于足量的稀盐酸中并充分混合,加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、干燥、
称重,得硫酸钡沉淀的质量,过滤,在滤液中加入过量的NaOH溶液,充分反应后,再将沉淀过滤、洗涤、灼烧、称重,得氧化铁的质量,根据硫酸钡的质量和氧化铁的质量可计算得硫酸根离子和铁离子的物质的量,根据电荷守恒可计算出氢氧根离子的物质的量,据此确定y:z的值;
②向①所得的混合物中加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、干燥、称重,若取此时的滤液少许,向其中滴加硫氰化钾溶液,可观察到的现象为 溶液呈血红色,反应的离子方程式为 Fe3++3SCN-=Fe(SCN)3,
故答案为:干燥;溶液呈血红色;Fe3++3SCN-=Fe(SCN)3;
③若向步骤②的滤液中加入过量的NaOH溶液,充分反应后,再将沉淀过滤、洗涤、灼烧、称重,得固体氧化铁为0.640g,其物质的量为0.004mol,①所得的混合物中加入足量的BaCl2溶液,得沉淀硫酸钡为2.330g,其物质的是来0.01mol,根据电荷守恒有n(OH-)+0.01mol×2=0.004mol×2×3,所以n(OH-)=0.004mol,所以y:z=0.004:0.01=2:5,
故答案为:2:5.
点评 本题考查了化学物质的制备方案的设计,题目难度中等,明确制备原理及化学实验操作方法为解答关键,对学生来说高铁不是很熟悉,但是铁与亚铁之间的转化还是很容易实现的,起点高,落点低,是一道质量较好的题目.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 合金的硬度一般比它的各成分金属的小,多数合金的熔点一般也比它的各成分金属的高 | |
| B. | 合金在工业上具有比纯金属更广泛的用途 | |
| C. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象 | 解释 | |
| A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | SO2能使酸性高锰酸钾溶液褪色 | SO2具有还原性 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| D | 铁与稀硝酸反应有气泡产生 | 铁与稀硝酸发生了置换反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素 | B. | 单质 | C. | 原子 | D. | 分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有的阴、阳离子总数为0.6mol | |
| B. | 在0.5 L该溶液中,Ba2+的浓度为0.1 moI/L | |
| C. | 在500 mL该溶液中,含有0.2molNO3- | |
| D. | 取1L该溶液稀释到10L时,NO3-的浓度为0.02 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,请写出两步反应中依次
,请写出两步反应中依次查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当x=n时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- | |
| B. | 当x=2n,反应的离子方程式为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| C. | 当x>n时,Fe2+和I-均被氧化 | |
| D. | 氧化性顺序:Cl2>I2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 喷泉实验中用于收集氨气的烧瓶 | |
| B. | 中和滴定中用的滴定管 | |
| C. | 配制一定物质的量浓度溶液实验用的容量瓶 | |
| D. | 排水法收集氧气实验用的集气瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com