
【题目】根据要求完成甲、乙两组实验。![]() 、b为弹簧夹,加热及固定装置已略去
、b为弹簧夹,加热及固定装置已略去![]()
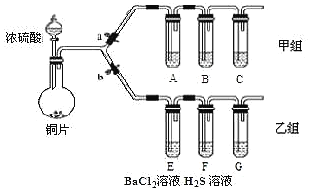
回答下列问题:
(1)制取![]() :写出铜与浓硫酸反应的化学方程式______。
:写出铜与浓硫酸反应的化学方程式______。
(2)用甲组装置验证酸性相对强弱:亚硫酸![]() 碳酸
碳酸![]() 硅酸
硅酸
①操作步骤:连接仪器、______、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
②甲组试管中的试剂分别是:![]() 饱和溶液,B______,C______。试剂B的作用是______。
饱和溶液,B______,C______。试剂B的作用是______。
③能说明酸性:亚硫酸![]() 碳酸
碳酸![]() 硅酸的实验现象是______。
硅酸的实验现象是______。
(3)用乙组装置验证![]() 的某些性质。打开b,关闭a;
的某些性质。打开b,关闭a;
④![]() 溶液中有浅黄色浑浊出现,反应的化学方程式是______。
溶液中有浅黄色浑浊出现,反应的化学方程式是______。![]() 溶液中无明显现象,将其分成a、b两份,
溶液中无明显现象,将其分成a、b两份,
⑤试管a中滴加NaOH溶液,产生白色沉淀的化学式是_______。
⑥试管b中滴加![]() 溶液,也产生白色沉淀,产生白色沉淀的化学式是______。
溶液,也产生白色沉淀,产生白色沉淀的化学式是______。
⑦上述④⑤⑥的反应分别验证![]() 的性质依次是
的性质依次是![]() 填序号
填序号![]() ④______;⑤______;⑥______。
④______;⑤______;⑥______。
A.酸性氧化物的通性![]() 碱性氧化物的通性
碱性氧化物的通性![]() 还原性
还原性![]() 氧化性
氧化性![]() 漂白性。
漂白性。
(4)装置G中盛放的溶液是______。
【答案】![]() 浓)
浓)![]() 检查装置的气密性 酸性
检查装置的气密性 酸性![]()
![]() 溶液 吸收
溶液 吸收![]() ,并检验
,并检验![]() 已除净 A中溶液产生气泡,B中紫红色溶液颜色变浅
已除净 A中溶液产生气泡,B中紫红色溶液颜色变浅![]() 或没有完全褪色
或没有完全褪色![]() ,C中出现白色沉淀
,C中出现白色沉淀 ![]()
![]()
![]() D A C NaOH溶液
D A C NaOH溶液
【解析】
(1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫气体和水,据此书写化学方程式;
(2)①装置A中制备二氧化硫气体,必须确保装置气密性良好,加入药品之前需检查装置气密性;
②A中碳酸氢钠和二氧化硫反应生成二氧化碳;试管B需要除去二氧化碳中混有的二氧化硫,并证明二氧化硫已经除尽,避免干扰二氧化碳与硅酸钠的反应;试管C中二氧化碳与硅酸钠溶液生成硅酸沉淀;
③试管A中溶液产生气泡,证明亚硫酸酸性大于碳酸,B中紫红色溶液颜色变浅(或没有完全褪色),证明二氧化硫已经除尽,C中出现白色沉淀,证明碳酸的酸性大于硅酸;
(3)④二氧化硫气体与H2S溶液常温下反应生成黄色固体硫(单质)和水;
⑤二氧化硫和水反应生成亚硫酸,亚硫酸和NaOH反应生成亚硫酸钠,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀;
⑥氯化铁具有氧化性,能把二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
⑦反应④中二氧化硫被还原,所以体现的是二氧化硫的氧化性;
反应⑤中二氧化硫和碱反应,体现了二氧化硫酸性氧化物通性;
反应⑥中二氧化硫被FeCl3氧化成硫酸根,体现了二氧化硫的还原性;
(4)G为尾气吸收装置,用于吸收多余的二氧化硫,可用氢氧化钠溶液。
(1)铜和热的浓硫酸反应,反应中Cu元素的化合价由0升高到![]() 价,作还原剂,产物为二氧化硫、硫酸铜和水,反应的方程式为:
价,作还原剂,产物为二氧化硫、硫酸铜和水,反应的方程式为:![]() 浓)
浓)![]() ;
;
故答案为:![]() 浓)
浓)![]() ;
;
(2)①装置A中反应制备二氧化硫气体,必须确保装置气密性良好,所以在加入药品之前需要检查装置的气密性;
故答案为:检查装置的气密性;
②![]() 中碳酸氢钠的作用是和二氧化硫反应生成二氧化碳;B中为酸性
中碳酸氢钠的作用是和二氧化硫反应生成二氧化碳;B中为酸性![]() 目的是除去二氧化硫,防止干扰二氧化碳和硅酸钠反应,若紫红色溶液颜色变浅
目的是除去二氧化硫,防止干扰二氧化碳和硅酸钠反应,若紫红色溶液颜色变浅![]() 或没有完全褪色
或没有完全褪色![]() 证明二氧化硫已经除净,C中为溶液
证明二氧化硫已经除净,C中为溶液![]() 溶液,利用强酸制弱酸生成硅酸沉淀证明酸性:亚硫酸
溶液,利用强酸制弱酸生成硅酸沉淀证明酸性:亚硫酸![]() 碳酸
碳酸![]() 硅酸;
硅酸;
故答案为:酸性![]() ;溶液
;溶液![]() 溶液;吸收
溶液;吸收![]() ,并检验
,并检验![]() 已除净;
已除净;
③当A中溶液产生气泡,B中紫红色溶液颜色变浅![]() 或没有完全褪色
或没有完全褪色![]() ,C中出现白色沉淀,可证明酸性:亚硫酸
,C中出现白色沉淀,可证明酸性:亚硫酸![]() 碳酸
碳酸![]() 硅酸;
硅酸;
故答案为:A中溶液产生气泡,B中紫红色溶液颜色变浅![]() 或没有完全褪色
或没有完全褪色![]() ,C中出现白色沉淀;
,C中出现白色沉淀;
(3)④二氧化硫中硫元素的化合价是![]() 价,有氧化性,二氧化硫气体与
价,有氧化性,二氧化硫气体与![]() 溶液常温下反应生成黄色固体硫
溶液常温下反应生成黄色固体硫![]() 单质
单质![]() 和水,反应方程式为:
和水,反应方程式为:![]() ;
;
故答案为:![]() ;
;
⑤试管a中滴加NaOH溶液,二氧化硫和水反应生成亚硫酸,亚硫酸和NaOH反应生成亚硫酸钠,亚硫酸根离子和钡离子反应生成![]() ;
;
故答案为:![]() ;
;
⑥试管b中滴加![]() 溶液,
溶液,![]() 具有氧化性,能把二氧化硫氧化成
具有氧化性,能把二氧化硫氧化成![]() 价的硫酸根离子,硫酸根离子和钡离子反应生成
价的硫酸根离子,硫酸根离子和钡离子反应生成![]() 白色沉淀;
白色沉淀;
故答案为:![]() ;
;
⑦反应④中二氧化硫和硫化氢反应,二氧化硫被还原,所以体现的是二氧化硫的氧化性,故选D项;
故答案为:D;
反应⑤中二氧化硫和碱反应,体现了二氧化硫酸性氧化物通性,故选A项;
故答案为:A;
反应⑥中二氧化硫被![]() 氧化成硫酸根,体现了二氧化硫的还原性,故选C项;
氧化成硫酸根,体现了二氧化硫的还原性,故选C项;
故答案为:C;
(4)G的作用是吸收尾气,防止污染空气,可盛放NaOH溶液;
故答案为:NaOH溶液。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水![]() 是一种重要的化工原料。某课外探究小组尝试制取无水
是一种重要的化工原料。某课外探究小组尝试制取无水![]() ,查阅资料获得下列信息:无水
,查阅资料获得下列信息:无水![]() 在
在![]() 升华,极易潮解,遇到水蒸气会产生白色烟雾。
升华,极易潮解,遇到水蒸气会产生白色烟雾。
探究一无水![]() 的实验室制备
的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉![]() 已除去氧化膜
已除去氧化膜![]() 反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液
反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液
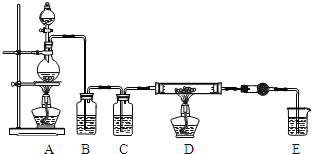
(1)写出装置A烧瓶中发生的反应方程式 ______ 。
(2)实验开始前,先检查装置气密性,然后装入药品,接下来的步骤依次是 ______ ![]() 填序号
填序号![]() 。
。
![]() 加热D中硬质玻璃管
加热D中硬质玻璃管
![]() 往A烧瓶中加入液体
往A烧瓶中加入液体
![]() 点燃A中的酒精灯
点燃A中的酒精灯
(3)上述供选药品中本实验无需用到的是 ______ ![]() 填数字序号
填数字序号![]() 。
。
(4)写出无水![]() 与水蒸气反应的化学方程式 ______ 。
与水蒸气反应的化学方程式 ______ 。
探究二无水![]() 的含量测定及结果分析
的含量测定及结果分析
取D中反应后所得固体![]() ,与足量氢氧化钠溶液反应,测定生成气体的体积
,与足量氢氧化钠溶液反应,测定生成气体的体积![]() 体积均换算成标准状况
体积均换算成标准状况![]() ,重复测定三次,数据如下:
,重复测定三次,数据如下:
第一次实验 | 第二次实验 | 第三次实验 | |
D中固体用量 |
|
|
|
氢气的体积 |
|
|
|
(5)根据表中数据,计算所得固体中无水![]() 的质量分数 ______ 。
的质量分数 ______ 。
(6)有同学认为测得的无水![]() 的质量分数偏低,你认为可能的原因有 ______ 。
的质量分数偏低,你认为可能的原因有 ______ 。
探究三离子浓度对氯气制备的影响
二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应停止不再产生氯气。探究小组对盐酸浓度降低影响氯气生成的原因进行如下探究:
(7)提出假设假设1:![]() 浓度降低影响氯气的生成
浓度降低影响氯气的生成
假设2: ______ 。
(8)设计方案进行实验。限选试剂:浓![]() 、NaCl固体、
、NaCl固体、![]() 固体、稀盐酸。
固体、稀盐酸。
步骤 | 实验操作 | 预测现象和结论 |
| 往不再产生氯气的装置中,加入 ______ ,继续加热 | 若有黄绿色气体生成,则假设1成立 |
| ______ | 若有黄绿色气体生成,则假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
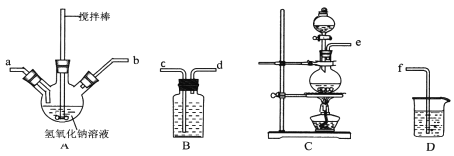
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
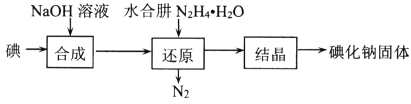
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常量的值,最早由奥地利化学及物理学家Johann JosefLoschmidt测得,有时候用上代替NA表示阿伏伽德罗常量的值,下来说法错误的是
A.1.1 g的11B中,含有0.5 NA个质子
B.pH=1的H3PO4溶液中,含有0.1 NA个H+
C.标准状态下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
D.1 L 1 mol/L NaCl溶液和1 L 1 mol/L NaF溶液中离子总数:前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做了如下实验:
装置 |
|
|
现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
下列说法中正确的是
A.加热铁片Ⅰ所在烧杯,电流表指针会发生偏转
B.用KSCN溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极
C.铁片Ⅰ、Ⅲ的腐蚀速率相等
D.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2(g) + N2(g)![]() 2NH3(g) △H〈0在一定条件下达到平衡状态,时间为t1时改变条件,化学反应速率与反应时间关系如图,下列说法中正确的是( )
2NH3(g) △H〈0在一定条件下达到平衡状态,时间为t1时改变条件,化学反应速率与反应时间关系如图,下列说法中正确的是( )
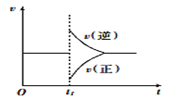
A.维持温度,反应体系体积不变,t1时充入NH3(g)
B.维持温度、压强不变,t1时充入NH3
C.维持温度不变,t1时扩大反应体系体积
D.维持压强不变,t1时升高反应体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.![]() 时
时![]() ,则该温度下
,则该温度下![]() 饱和溶液中含有
饱和溶液中含有![]() 个
个![]()
B.铅蓄电池放电时负极净增质量比正极净增质量多![]() 时,转移电子数为
时,转移电子数为![]()
C.![]() 溶于水,溶液中
溶于水,溶液中![]() 、
、![]() 、
、![]() 的总数为
的总数为![]()
D.![]() 叠氮化铵
叠氮化铵![]() 发生爆炸
发生爆炸![]()
![]()
![]() 。当转移
。当转移![]() 个电子时,产生
个电子时,产生![]() 标准状况
标准状况![]() 混合气体
混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com