
| A.等物质的量的N2和CO所含分子数均为NA |
| B.一定温度下,1 L 0.5 mol·L-1NH4Cl溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH的物质的量相同 |
| C.1 mol Na2O2固体中含离子总数为3NA |
| D.标准状况下,2.24 L庚烷所含分子数为0.1NA |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/L | B.0.2mol/L | C.0.4mol/L | D.0.8mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
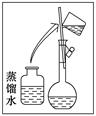
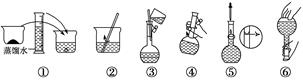
| | a | b | c | d | e |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
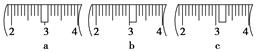
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
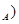 无关的组合是
无关的组合是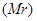 ②摩尔质量(M) ③原子半径(r) ④物质的量(n) ⑤气体摩尔体积(V
②摩尔质量(M) ③原子半径(r) ④物质的量(n) ⑤气体摩尔体积(V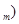
| A.①③⑥⑦ | B.②④⑤⑥ | C.①②③⑤ | D.②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4 g重水(D2O)中所含质子数为0.2×6.02×1023 |
| B.4.48 L N2与CO的混合物所含分子数为0.2×6.02×1023 |
| C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2×6.02×1023 |
| D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
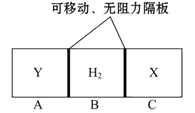
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═ Mn2+ +
Mn2+ + O2 +
O2 +  H2O
H2O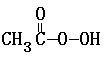 + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═  Mn2++
Mn2++  O2 +
O2 +  H2O
H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com