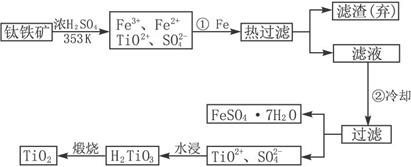
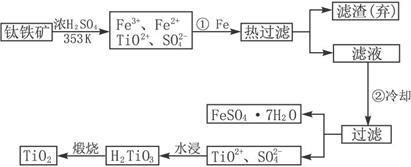
�ѣ�Ti ������Ϊ��������֮��ĵ�������������ͼ��ʾ�����ѳ����ȼ�ͼ״�����ɲ�ҵ�����Դ�������Դ�����ʣ����ٻ�����Ⱦ������д���пհף�
��l����ⱥ��ʳ��ˮʱ���ܷ�Ӧ�����ӷ���ʽ��
2Cl
-+2H
2O

2OH
-+H
2��+Cl
2��
2Cl
-+2H
2O

2OH
-+H
2��+Cl
2��
��
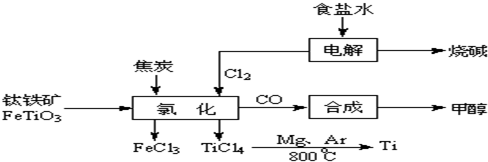
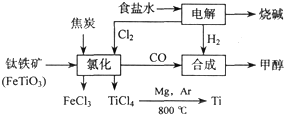
��2��д���������Ȼ����õ����Ȼ��ѵĻ�ѧ����ʽ������д������
2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO
2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO
��
��3����֪����Mg��s��+Cl
2��g��=MgCl
2��s����H=-641kJ?mol
-1��Ti��s��+2Cl
2��g��=TiCl
4��s����H=-770kJ?mol
-1��2Mg��s��+TiCl
4��s��=2MgCl
2��s��+Ti��s����H=
-512kJ/mol
-512kJ/mol
��
��Ӧ2Mg��s��+TiCl
4��s��

2MgCl
2��s��+Ti����Ar�����н��е������ǣ�
Mg��Ti����ǿ��ԭ�ԣ���Ar�����п��Է�ֹ��������
Mg��Ti����ǿ��ԭ�ԣ���Ar�����п��Է�ֹ��������
��
��4����������ҵ���У��ϳ�96t �״�����������ⲹ��H
25
5
t ���������������������ʵ��κ���ʧ����
��5���Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�أ���֪��ȼ�ϵ�ص��ܷ�ӦʽΪ��2CH
3OH+3O
2+4OH
-=2CO
32-+6H
2O�����������ĵ缫����ʽΪ��3O
2+6H
2O+12e
-=12OH
-���õ���и����ϵĵ缫��Ӧʽ��
2CH3OH-12e-+16OH-=2CO32-+12H2O
2CH3OH-12e-+16OH-=2CO32-+12H2O
��





 2OH-+H2��+Cl2��
2OH-+H2��+Cl2�� 2OH-+H2��+Cl2��
2OH-+H2��+Cl2�� 2MgCl2��s��+Ti����Ar�����н��е������ǣ�
2MgCl2��s��+Ti����Ar�����н��е������ǣ�