
 .
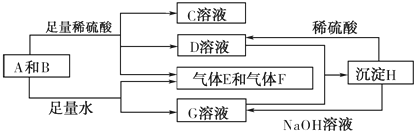
.分析 沉淀H既能与稀硫酸反应,又能与NaOH溶液反应,而D、G两溶液混合可以生成H,故为两性氢氧化物Al(OH)3,故A为铝,B为Na2O2,C、D、G分别为Na2SO4、Al2(SO4)3、NaAlO2.铝与氢氧化钠溶液反应的氧化剂是水,0.4mol铝转移电子数为1.2mol,消耗水的物质的量为1.2mol,则水的质量为:18g/mol×1.2mol/=21.6g,电解Na2SO4溶液,实际上是电解的水,电解水的化学方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,即消耗2mol水共生成3mol气体,标准状况下体积为67.2L,转移4mol电子.
解答 解:沉淀H既能与稀硫酸反应,又能与NaOH溶液反应,而D、G两溶液混合可以生成H,故为两性氢氧化物Al(OH)3,故A为铝,B为Na2O2,C、D、G分别为Na2SO4、Al2(SO4)3、NaAlO2,
(1)A为Al,原子核外有3个电子层,最外层电子数为3,则位于周期表第三周期第ⅢA族,
故答案为:三;ⅢA;
(2)化合物B为Na2O2,过氧化钠为离子化合物,其电子式为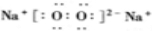 ,
,
故答案为: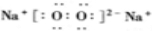 ;
;
(3)D、G分别为Al2(SO4)3、NaAlO2,Al3+与AlO2-可发生互促水解生成Al(OH)3,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)D为Al2(SO4)3,为强酸弱碱盐,在溶液中发生Al3++3H2O?Al(OH)3+3H+,溶液呈酸性,
故答案为:<;Al3++3H2O?Al(OH)3+3H+;
(5)铝与氢氧化钠溶液反应的氧化剂是水,0.4mol铝转移电子数为1.2mol,消耗水的物质的量为1.2mol,则水的质量为:18g/mol×1.2mol/=21.6g,
故答案为:21.6;
(6)电解Na2SO4溶液,实际上是电解的水,电解水的化学方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,电池的正极反应式为:O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O.
点评 本题综合考查无机物的推断,题目难度较大,注意以H的转化关系为该题的突破口,明确物质的种类为解答该类题目的关键,注意掌握相关物质的性质,试题培养了学生的分析能力及逻辑推理能力.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 为了防止富脂食品氧化变质,延长食品的保质期,常在包装袋中放入生石灰 | |
| B. | 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液 | |
| C. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在银氨溶液中可大量含有:Cu2+、K+、Cl-、SO42- | |
| B. | 使甲基橙试液变红色的溶液中可大量含有:K+,Na+,S2-,SO32- | |
| C. | 室温下,pH=12的碱性溶液中一定没有CH3COOH分子 | |
| D. | 在c(H+)=10-14mol/L的溶液中可大量含有:Na+,AlO2-,CO32-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
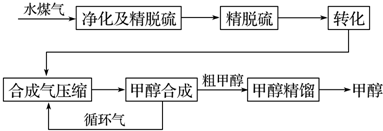
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物:CO2、Mn2O7 | B. | 胶体:淀粉溶液、氯化铁溶液 | ||
| C. | 同素异形体:1H2O、D2O | D. | 碱式盐:Cu2(OH)2CO3、NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHCO3溶液中加入过量的Na2O2粉末 | |
| B. | 向KI和NaBr混合溶液中通入过量的Cl2 | |
| C. | 向NaAlO2溶液中加入过量的HCl溶液 | |
| D. | 将物质的量相同的(NH4)2SO4溶液和BaCl2溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L SO3含有的分子数为NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+数目为0.02NA | |
| C. | 将含1molFeCl3的溶液制得的Fe(OH)3胶体中含胶粒数为NA(假设所有的FeCl3都转化为Fe(OH)3胶体) | |
| D. | 物质的量浓度为0.5 mol•L-1 MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.5 mol/L NaHCO3溶液中含有的HCO3-数目小于0.5 NA | |
| B. | 11.2 g 铁粉与硝酸反应失去电子数一定为0.6 NA | |
| C. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2 NA | |
| D. | 46 g甲苯含有C=C双键的数目为1.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com