
| A. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 氢气的标准燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=285.5 kJ•mol-1 | |
| C. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量. 则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 |
分析 A.醋酸是弱酸存在电离平衡,电离过程是吸热过程;
B.反应的焓变和化学方程式中物质的量有关,且吸热反应应该为“+”号;
C.依据n=$\frac{m}{M}$计算物质的量分析判断;
D.依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析.
解答 解:A.稀醋酸是弱酸电离过程是吸热过程,与0.1mol•L-1NaOH溶液反应放出的热量小于中和热,焓变是负值则:H+(aq)+OH-(aq)═H2O(l)△H>-57.3kJ•mol-1,故A错误;
B.已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+571kJ•mol-1,故B错误;
C.密闭容器中,9.6g硫粉物质的量为0.3mol,与11.2g铁粉物质的量为0.2mol混合加热生成硫化亚铁17.6g时,硫过量,放出19.12kJ热量,所以1mol铁反应放热=19.12kJ×$\frac{1mol}{0.2mol}$=95.6kJ,该热化学方程式为:Fe(s)+S(s)═FeS(s)△H=-95.6kJ•mol-1 ,
D.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,碳燃烧生成的一氧化碳不是稳定氧化物,故D错误;
故选C.
点评 本题考查热化学方程式,题目难度不大,明确燃烧热、中和热放热概念为解答关键,注意掌握热化学方程式的书写原则及表示意义,试题培养了学生的分析能力及灵活应用能力.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应是放热反应还是吸热反应,由生成物与反应物的焓值差决定 | |
| B. | 升高温度,可以改变化学反应的反应热 | |
| C. | △H的大小与热化学方程式中的化学计量数无关 | |
| D. | 1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+11.9 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 已知在稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol.若将含0.5mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 甲烷的标准燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2 O2(g)═CO2(g)+2H2O (g)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
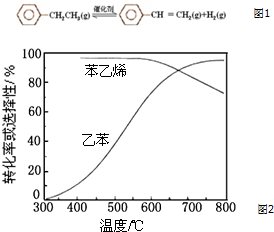 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | X | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
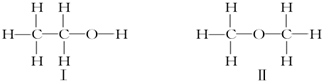
| A. | Ⅰ和Ⅱ是同分异构体 | B. | Ⅰ和Ⅱ物理性质完全相同 | ||
| C. | Ⅰ和Ⅱ化学性质相同 | D. | Ⅰ和Ⅱ的分子式不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com