
 �ǿ��淴Ӧ��Ӧ�ﲻ����ȫת����
�ǿ��淴Ӧ��Ӧ�ﲻ����ȫת���� ���� ��1��������������ͷ�Ӧ�Ļ�ܣ�����Ӧ�Ȳ��䣻
��2�����ݿ��淴Ӧ������ȫ��Ӧ���ص������
��� �⣺��1��������������ͷ�Ӧ�Ļ�ܣ���E1��E2����С�������֮��䣬��Ӧ�Ȳ��䣻
�ʴ�Ϊ����С����С��
��2����0.5mol N2��1.5mol H2��ȫ��Ӧʱ�����ܷų�46.2kJ������������ӦΪ���淴Ӧ��������ȫ���У����ܱ������г���0.5mol N2��1.5mol H2����ַ�Ӧ�ų�������С��46.2kJ��
�ʴ�Ϊ���������淴Ӧ��Ӧ�ﲻ����ȫת����
���� ���⿼���˴����Ի�ܵ�Ӱ�켰���淴Ӧ���ʱ䣬ע�����Ӱ���ܴ�С����Ŀ�ѶȲ���


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
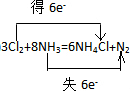
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ӧ�ù㷺 | |
| B�� | ���������뽺�����ӵijߴ�����൱ | |
| C�� | �������ڽ�����ϵ | |
| D�� | ���ֽ�������Һ�ķ��������ö�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
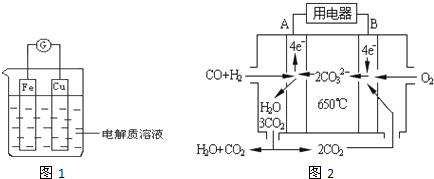
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2NH4Cl+Ba��OH��2•10H2O�TBaCl2+2NH3��+12H2O��H��0 | |
| B�� | Fe3++3SCN-?Fe��SCN��3 ��H��0 | |
| C�� | N2��g��+3H2��g��?2NH3��g����H��0 | |
| D�� | CaO+H2O�TCa��OH��2 ��H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D |
| �Ҵ� | ������ | ��Ȼ�� | ���� |
 |  |  |  |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������� | B�� | ǰ���Ǻ��ߵ�105�� | ||
| C�� | ������ǰ�ߵ�104�� | D�� | ���Ƚ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ӵ��ξ��ǡ�I2+NaCl�� | B�� | �ӵ��ξ���NaCl�м���KI | ||
| C�� | �ӵ�����NaCl�м�������KIO3 | D�� | �ӵ��ξ��Ǵ�KIO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ռ�����һ����� | B�� | ����ԭ��������� | ||
| C�� | ��������������� | D�� | ������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com