
| A. | CH4分子的比例模型: | B. | 氯原子的结构示意图: | ||
| C. | NH3分子的电子式: | D. | CO2分子的结构式:O=C=O |
分析 A. 为甲烷的球棍模型,不是比例模型;
为甲烷的球棍模型,不是比例模型;
B.氯原子的核电荷数=核外电子总数=17,最外层为7个电子;
C.氨气中含有3个氮氢键,氮原子最外层达到8电子稳定结构;
D.二氧化碳为直线型结构,分子中含有两个碳氧双键.
解答 解:A.甲烷为正面体结构,由原子相对大小表示空间结构为比例模型,则CH4分子的比例模型为 ,故A错误;
,故A错误;
B.氯原子的最外层电数为7,其正确的原子结构示意图为: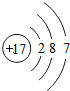 ,故B错误;
,故B错误;
C.氨气的电子式中漏掉了氮原子的一对未成键电子对,氨气正确的电子式为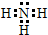 ,故C错误;
,故C错误;
D.二氧化碳分子中含有两个碳氧双键,其结构式为:O=C=O,故D正确;
故选D.
点评 本题考查了常见化学用语的书写判断,题目难度中等,涉及电子式、原子结构示意图、比例模型、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生规范答题的能力.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | C | |
| D | B | E |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据分散系是否有丁达尔现象,将分散系分为胶体、浊液和溶液 | |
| B. | 用盐酸可以清洗长期存放过FeCl3溶液的试剂瓶 | |
| C. | 二氧化硅广泛用于制作计算机芯片和光导纤维 | |
| D. | 电解精炼铜时,阳极泥中含有Fe、Ag、Au等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢是铁的一种合金 | |
| B. | 通常合金的硬度比不上纯净的金属 | |
| C. | 合金是两种金属熔合而成的具有金属特性的物质 | |
| D. | 一般地说合金的熔点比它的各成分金属的熔点都高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com