
【题目】A、B、C、D、E、F、G和J是元素周期表中前20号的主族元素,其原子序数依次增大。已知:
①A和D为同主族元素,且A的单质是最轻的气体;
②B元素最高价氧化物的水化物与其气态氢化物反应生成盐;
③F、G相邻,C的核电荷数是F核外电子数的一半,F与J可形成离子化合物J2F;
④E元素是地壳中含量最多的金属元素。
完成下列填空:
(1)ACD三种元素共同形成的化合物的电子式为____________,其微粒间存在的化学键有____________;将这种化合物滴入EG两种元素形成的化合物溶液中,直至过量,总反应的离子方程式为__________________。
(2)E元素位于周期表的第____________周期____________族。
(3)铜与B元素最高价氧化物的水化物的浓溶液反应的离子方程式为_________________。
(4)F、G分别与A形成的化合物,还原性强的是_______(填写相应的化学式)。
(5)F简单阴离子的结构示意图_______,且F、G、J简单离子的半径由大至小的顺序是_______(填写相应离子符号)
(6)实验室制取单质G的化学方程式为____________________________,
比较F、G的最高价氧化物的水化物的酸性(填写相应化学式)_______>_______。
(7)一种燃料电池,以铂为电极插入KOH溶液中,分别向两极通入A单质和C单质。通入C单质的一极是_______极,电极反应式为:________________________。
【答案】(1)![]() (1分);离子键和共价键(2分);Al3++4OH-=2H2O+AlO2-(2分)
(1分);离子键和共价键(2分);Al3++4OH-=2H2O+AlO2-(2分)
(2)3、IIIA(2分)
(3)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O(2分)
(4)H2S(1分)
(5)![]() (1分);S2->Cl->K+
(1分);S2->Cl->K+
(6)MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O(2分)HClO4>H2SO4(2分)
(7)正(1分);O2+2H2O+4e-=4OH-(2分)
【解析】试题分析:元素周期表中前20号的主族元素,其原子序数依次增大。A的单质是最轻的气体,则A为H元素;B元素最高价氧化物的水化物与其气态氢化物反应生成盐,则B为N元素;E元素是地壳中含量最多的金属元素,则E为Al元素;A和D为同主族元素,且A为H元素,且原子序数依次增大,则D为Na元素;C的核电荷数是F核外电子数的一半,若C为氟元素,此时F为18号0族元素氩,不符合题意,若C为氧元素,此时F为硫元素;F、G相邻,则G为氯元素;F与J可形成离子化合物J2F,则J为钾元素。
(1)ACD三种元素共同形成的化合物为NaOH,其电子式为![]() ,其微粒间存在的化学键有离子键和共价键;将NaOH滴入AlCl3溶液中至过量,反应的离子方程式为Al3++4OH-=2H2O+AlO2-。
,其微粒间存在的化学键有离子键和共价键;将NaOH滴入AlCl3溶液中至过量,反应的离子方程式为Al3++4OH-=2H2O+AlO2-。
(2)Al元素位于周期表的第3周期IIIA族。
(3)铜与浓硝酸反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O。
(4)非金属性越强,对应氢化物的还原性越弱,则在H2S和HCl中,还原性强的是H2S。
(5)S的简单阴离子S2-的结构示意图为![]() ;电子层排布相同的离子,原子序数越大,半径越小,则S2-、Cl-、K+的半径由大至小的顺序是S2->Cl->K+。
;电子层排布相同的离子,原子序数越大,半径越小,则S2-、Cl-、K+的半径由大至小的顺序是S2->Cl->K+。
(6)实验室用MnO2和浓盐酸加热制取Cl2,化学方程式为MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;非金属性越强,最高价氧化物的水化物的酸性越强,则酸性HClO4>H2SO4。
(7)氢氧燃料电池通入氧气的一极是正极,电极反应式为:O2+2H2O+4e-=4OH-


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各原子或离子的电子排布式错误的是
A. Mg2+ 1s22s22p6 B. F 1s22s22p5
C. Ar 1s22s22p63s23p6 D. Cr 1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不和水反应生成硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH相同的盐酸和醋酸溶液加水稀释后随溶液体积变化的曲线如右图所示。据图判断正确的是( )
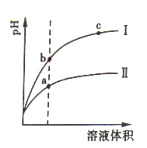
A.Ⅱ为盐酸稀释时pH值变化曲线 B.a点Kw的数值比c点Kw的数值大
C.b点溶液的导电性比c点溶液的导电性强 D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的乙烯与甲烷,所含分子数之比为_____________,碳原子个数之比为_____________,氢原子个数之比为______________,若充分燃烧,消耗O2的体积比为_________;0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com