
��8�֣�[��ѧ����ѧ�뼼��]
��ͭ�к���������п������������Ƚ����������������ʣ������Ӧ������ʵ����������������ͭ��ҺΪ���Һ���õ��ķ����Դ�ͭ�ᴿ������������͵��Һ�н������л��պͺ����ⶨ���ش��������⣻
��1������һ����⾫�ƣ��������У�����ͭ��Ũ�Ȼ� ��ѡ�����䡢��С����
������������ɺԵ��Һ���д�����
��2����������ۺ����ã�
ϡ���ᴦ��������õ�������ϡ��Һ����д���ò���Ӧ�����ӷ���ʽ�� ��
�������м������Ļƽ���λ��ս����Dz������й����ϣ��˽��һЩ�йؽ��֪ʶ�����������ǻ�ȡ��һЩ��Ϣ��
|
��� |
��Ӧ |
ƽ�ⳣ�� |
|
1 |
Au + 6HNO3��Ũ��= Au(NO3)3 + 3NO2��+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl�� = AuCl4�� |
>>1 |
���п�֪������������ᷴӦ����ȴ��������ˮ��Ũ���������ᰴ�����l��3�Ļ����������Ҫ���ͽ��ܹ�������ˮ��ԭ�� ��
��3�����Һ�����IJⶨ����ͼ�Ǹ�С��̽�����Һ��һ��ʵ�����̣�

��100mL��Һ��Cu2+ ��Ũ��Ϊ mol��L��1 ��Fe2+��Ũ��Ϊ mol��L��1

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
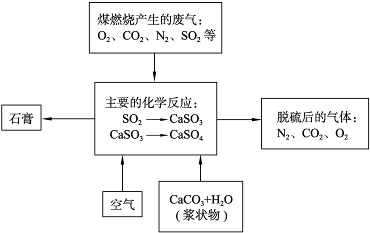
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

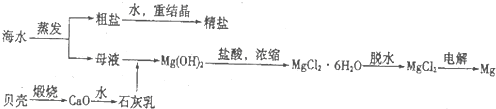
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �������� | pH | |
| ��ʼ���� | ������ȫ | |
| Fe2+ | 6.3 | 9.7 |
| Cu2+ | 4.7 | 6.7 |
| Fe3+ | 1.9 | 3.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �ɷ� | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO 42- | HCO 3+ | ����/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
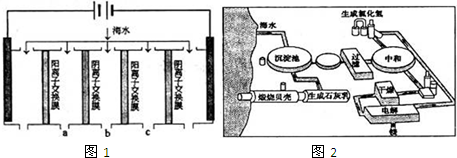
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com