
| ¼× | ŅŅ | ±ū | ¶” | ||
| ĆܱÕČŻĘ÷Ģå»ż/L | 2 | 2 | 2 | 1 | |
| ĘšŹ¼ĪļÖŹµÄĮæ | n£ØSO2£©/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n£ØO2£©/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2µÄĘ½ŗā×Ŗ»ÆĀŹ% | 80 | ¦Į1 | ¦Į2 | ¦Į3 | |
| A£® | ¼×ÖŠ·“Ó¦µÄĘ½ŗā³£ŹżŠ”ÓŚŅŅ | |
| B£® | øĆĪĀ¶ČĻĀ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżKĪŖ400 | |
| C£® | SO2µÄĘ½ŗā×Ŗ»ÆĀŹ£ŗ¦Į1£¾¦Į2=¦Į3 | |
| D£® | ČŻĘ÷ÖŠSO3µÄĪļÖŹµÄĮæÅØ¶Č£ŗ±ū=¶”£¼¼× |
·ÖĪö A£®ĪĀ¶ČĻąĶ¬Ź±£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż²»±ä£»
B£®øł¾Ż¼×ÖŠø÷ĪļÖŹµÄĘ½ŗāÅØ¶Č¼ĘĖćĘ½ŗā³£Źż£»
C£®Óɼה¢ŅŅæÉÖŖ£¬ŃõĘųµÄÅضČĻąĶ¬£¬¶žŃõ»ÆĮņµÄÅضČŌö“ó»į“Ł½ųŃõĘųµÄ×Ŗ»Æ£¬¶žŃõ»ÆĮņ×Ŗ»ÆĀŹ¼õŠ”£¬±ūŗĶ¶”“ļµ½µÄŹĒĻąĶ¬µÄĘ½ŗāדĢ¬£¬±ūŹµŃéŃõĘųĪļÖŹµÄĮæŌö“ó£¬ŃõĘų×Ŗ»ÆĀŹŌö“ó£»
D£®Ģå»żĻąĶ¬£¬±ūÖŠµÄĘšŹ¼ÅضČĪŖ¼×µÄ2±¶£¬Ń¹ĒæŌö“ó£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬Ōņ±ūÖŠ×Ŗ»ÆĀŹŌö“󣬱ūŗĶ¶”Ę½ŗāŹĒĻąĶ¬µÄĘ½ŗā£®
½ā“š ½ā£ŗA£®ĪĀ¶ČĻąĶ¬Ź±£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż²»±ä£¬Ōņ¼×”¢ŅŅÖŠ·“Ó¦µÄĘ½ŗā³£ŹżĻąµČ£¬¹ŹA“ķĪó£»
B£® 2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©£¬
æŖŹ¼£Ømol£© 0.4 0.24 0
×Ŗ»Æ£Ømol£© 0.32 0.16 0.32
Ę½ŗā£Ømol£© 0.08 0.08 0.32
Ę½ŗāÅØ¶Č£Ømol/L£©0.04 0.04 0.16
ĖłŅŌøĆĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżÖµĪŖ£ŗK=$\frac{0.1{6}^{2}}{0.0{4}^{2}”Į0.04}$=400£¬¹ŹBÕżČ·£»
C£®Óɼה¢ŅŅæÉÖŖ£¬ŃõĘųµÄÅضČĻąĶ¬£¬¶žŃõ»ÆĮņµÄÅضČŌö“ó»į“Ł½ųŃõĘųµÄ×Ŗ»Æ£¬¶žŃõ»ÆĮņ×Ŗ»ÆĀŹ¼õŠ”£¬±ūŗĶ¶”“ļµ½µÄŹĒĻąĶ¬µÄĘ½ŗāדĢ¬£¬±ūŹµŃéŃõĘųĪļÖŹµÄĮæŌö“ó£¬ŃõĘų×Ŗ»ÆĀŹŌö“ó£»Ōņ¶žŃõ»ÆĮņ×Ŗ»ÆĀŹ£¬¦Į1£¼¦Į2=¦Į3£¬¹ŹC“ķĪó£»
D£®Ģå»żĻąĶ¬£¬±ūÖŠµÄĘšŹ¼ÅضČĪŖ¼×µÄ2±¶£¬Ń¹ĒæŌö“ó£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬Ōņ±ūÖŠ×Ŗ»ÆĀŹŌö“󣬼“±ūÖŠc£ØSO3£©“óÓŚ¼×ÖŠc£ØSO3£©µÄ2±¶£¬±ūĢå»żĪŖ2L£¬¶”Ģå»żĪŖ1L£¬ĘšŹ¼Įæ·Ö±šĪŖ0.8£¬0.48£»0.40£¬24£¬±ūŗĶ¶”“ļµ½µÄĘ½ŗāĻąĶ¬£¬ČżŃõ»ÆĮņÅضČĻąĶ¬£¬±ū=¶”£¾¼×£¬¹ŹD“ķĪó£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬ŹģĻ¤»ÆŃ§Ę½ŗāµÄČż¶Ī·Ø¼ĘĖć¼°Ó°ĻģĘ½ŗāŅĘ¶ÆµÄŅņĖŲ¼“æɽā“š£¬×¢ŅāĘ½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬ŹŌĢāÅąŃųĮĖѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦¼°»Æѧ¼ĘĖćÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČĘųæÉÓĆÓŚ×ŌĄ“Ė®Ļū¶¾ | |
| B£® | 40%µÄ¼×Č©Ė®ČÜŅŗæÉÓĆ×÷·ĄøƼĮ£¬½žÖĘÉśĪļ±ź±¾ | |
| C£® | ¹¤Ņµ¾Ę¾«æÉÓĆÓŚÄšŌģŅūÓĆ¾Ę | |
| D£® | Ź³ŃĪÖŠĢķ¼ÓµāĖį¼Ų£ØKIO3£©¼Ó¹¤µāŃĪ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
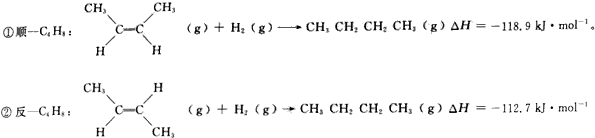


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ·“Ó¦Ź±¼ä/min | n£ØSO2£©/mol | n£ØO2£©/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A£® | ·“Ó¦ŌŚĒ° 5min µÄĘ½¾łĖŁĀŹĪŖ v £ØSO2£©=0.08mol•L-1•min-1 | |
| B£® | ±£³ÖĪĀ¶Č²»±ä£¬ĻņĘ½ŗāŗóµÄČŻĘ÷ÖŠŌŁ³äČė 1molSO2ŗĶ 0.5molO2Ź±£¬v £ØÕż£©£¾v £ØÄę£© | |
| C£® | øĆĪĀ¶Č£¬·“Ó¦µÄĘ½ŗā³£ŹżĪŖ 11.25L•mol-1 | |
| D£® | ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė 1.5mol SO3£¬“ļĘ½ŗāŹ± SO3µÄ×Ŗ»ÆĀŹĪŖ 40% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| »ÆѧŹ½ | CH3COOH | H2CO3 | AgCl | Ag2CrO4 |
| Ka»ņKsp | Ka=1.8”Į10-5 | Ka1=4.1”Į10-7 Ka2=5.6”Į10-11 | Ksp=1.8”Į10-10 | Ksp=2.0”Į10-12 |
| A£® | ³£ĪĀĻĀ£¬ĻąĶ¬ÅØ¶Č¢ŁCH3COONH4 ¢ŚNH4HCO3 ¢Ū£ØNH4£©2CO3ČÜŅŗÖŠ£¬c£ØNH4+£©Óɓ󵽊”µÄĖ³ŠņŹĒ£ŗ¢Ł£¾¢Ś£¾¢Ū | |
| B£® | Ļņ±„ŗĶĀČĖ®ÖŠµĪ¼ÓNaOH ČÜŅŗÖĮČÜŅŗøÕŗĆĪŖÖŠŠŌŹ±£¬c£ØNa+£©=2c£ØClO-£©+c£ØHClO£© | |
| C£® | AgCl Ņ×ČÜÓŚ°±Ė®ÄŃČÜÓŚĖ®£¬ĖłŅŌAgCl ŌŚ°±Ė®ÖŠµÄKsp “óÓŚĖ®ÖŠµÄ Ksp | |
| D£® | ĻņÅØ¶Č¾łĪŖ1”Į10-3mol•L-1µÄKCl ŗĶK2CrO4»ģŗĻŅŗÖŠµĪ¼Ó1”Į10-3mol•L-1 µÄAgNO3ČÜŅŗ£¬CrO42-ĻČŠĪ³É³Įµķ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪļÖŹ | X | Y | Z | Q |
| Ź±¼ä | ||||
| ĘšŹ¼/mol | 0.7 | 1 | ||
| 2minĩ/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3minĩ/mol | 0.8 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
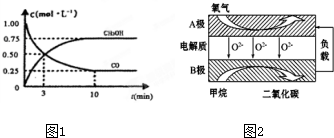
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £Ø1£©·“Ó¦A£Øg£©+B£Øg£©?C£Øg£©+D£Øg£©¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£ØE1£¾0£¬E2£¾0£©£¬»Ų“šĻĀĮŠĪŹĢā£®
£Ø1£©·“Ó¦A£Øg£©+B£Øg£©?C£Øg£©+D£Øg£©¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£ØE1£¾0£¬E2£¾0£©£¬»Ų“šĻĀĮŠĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com