
【题目】25℃时,氯水中部分含氯的物质的量浓度分数(某物质的物质的量浓度占各物质的量浓度之和的百分数)与pH的关系如图所示。下列叙述正确的是( )

A.pH=1的新制氯水中,c(Cl2)>c(ClO-)>c(HClO)
B.随着pH增大,溶液颜色不断加深
C.pH>10时,溶液中含氯微粒主要为ClO-和Cl-
D.pH=4的氯水中加入NaOH溶液,只发生离子反应HClO+OH-=ClO-+H2O
【答案】C
【解析】
A.根据pH=1时溶液中各种微粒的含量分步解答;
B.在氯水中只有Cl2是有色物质,其余物质均为无色,根据Cl2与溶液pH关系判断;
C.Cl2在水中存在化学平衡:Cl2+H2O![]() HCl+HClO,根据溶液的酸碱性及图示分析解答;
HCl+HClO,根据溶液的酸碱性及图示分析解答;
D.在pH=4的氯水中含有HCl、Cl2、HClO等,结合物质的化学性质分析。
A.根据图示可知,在pH=1时,氯水中各种微粒的含量:c(Cl2) >c(HClO)>c(ClO-),A错误;
B.在氯水中只有Cl2是有色物质,其余物质均为无色,由图示可知,随着溶液pH的增大,Cl2的含量逐渐降低,因此溶液的颜色逐渐变浅,B错误;
C.Cl2在水中存在化学平衡:Cl2+H2O![]() HCl+HClO,当溶液pH>10时,发生反应HCl+NaOH=NaCl+H2O,HClO+NaOH=NaClO+H2O,溶液中Cl2及HClO很少,根据图示也可看出溶液中含氯微粒主要为ClO-和Cl-,C正确;
HCl+HClO,当溶液pH>10时,发生反应HCl+NaOH=NaCl+H2O,HClO+NaOH=NaClO+H2O,溶液中Cl2及HClO很少,根据图示也可看出溶液中含氯微粒主要为ClO-和Cl-,C正确;
D.在pH=4的氯水中含有大量的HCl、Cl2、HClO等,所以发生的反应,有H++OH-=H2O、Cl2+2OH-=Cl-+ClO-+H2O,HClO+OH-=ClO-+H2O,所以不仅有HClO+OH-=ClO-+H2O,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出(溶液体积变化忽略不计),所得溶液Q中的![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 溶液Q比原溶液增重了1.92g.
B. Q中n(Cu2+):n(Fe3+)=3:4
C. 反应中转移的电子数为0.04mol
D. n(Cu2+)=0.03mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移6 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
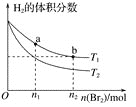
A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3为黑棕色固体,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解。
(1)甲组同学拟用下列装置制取纯净干燥的氯气。
①装置B的作用是_________
②装置A中发生反应时消耗的氧化剂和还原剂的物质的量之比为__________
(2)乙组同学选用甲组实验中的装置ABC和下列装置制取FeCl3
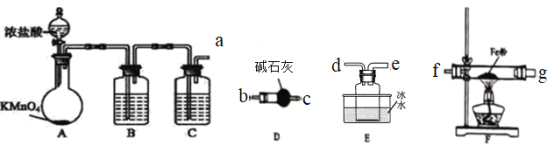
①乙组同学的实验装置中,依次连接的合理顺序为:a→_____→_____→_____→_____→_____→_____
②连好装置,检查装置的气密性,先打开装置A中___________(填仪器的名称)的活塞,直到______再点燃装置F处的酒精灯,目的是_______
③装置D的作用有_______
(3)实验结束后,取少量F中的固体加水溶解,欲对所得产物FeCl3中是否含有FeCl2进行检测,所需试剂是_______
a.KSCN b.H2O2 c.K3[Fe(CN)6] d. .K4[Fe(CN)6]
经检测发现溶液中含有Fe2+,丙同学认为所得产物FeCl3中一定含有FeCl2,丁同学认为不一定,理由是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是( )
A. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
B. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
D. 39g钾与氧气完全反应,生成K2O转移NA个电子,生成KO2转移2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图1 为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图2 为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线,温度均由22℃上升到70℃。下列判断不正确的是
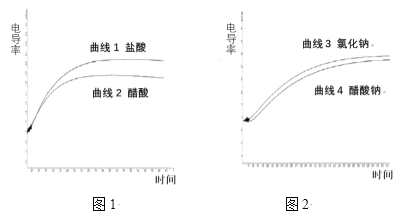
A. 由曲线1可以推测:温度升高可以提高离子的迁移速率
B. 由曲线4可以推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关
C. 由图1和图2可以判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是Cl-的迁移速率大于CH3COO-的迁移速率
D. 由图1和图2可以判定:两图中电导率的差值不同,与溶液中H+、OH-的浓度和迁移速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、M、R为短周期元素,X、R在同一主族,![]() 与
与![]() 具有相同的电子层结构,X原子的L层电子数是K层电子数的2倍。判断下列说法正确的是
具有相同的电子层结构,X原子的L层电子数是K层电子数的2倍。判断下列说法正确的是
A.R的最高价氧化物对应水化物的酸性比Y的强
B.X、Y、M均可形成多种氧化物
C.X的简单气态氢化物的热稳定性比Y的强
D.离子半径的大小:r(![]() )>r(
)>r(![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com